2025年末,张锋在《自然》杂志刊登了一项突破性研究,这位因CRISPR基因编辑技术而闻名于世的华裔科学家,正式踏入一个全新的、挑战性极高的领域:对抗衰老。
张峰团队提出了一种全新的抗衰老免疫策略:通过改造肝脏,让其成为一个临时的"免疫因子工厂",从而逆转衰老导致的免疫功能衰退。这一跨界研究不仅展示了mRNA技术在衰老干预中的巨大潜力,更开辟了一条安全、可控的免疫年轻化路径[1]。

免疫衰老:衰老背后的免疫力“滑坡”真相
随着年龄增长,很多人会发现自己越来越“不禁造”——感冒好得慢、疫苗效果差、癌症风险也悄悄升高。这背后的“元凶”,是一种叫“免疫衰老”的生理过程,核心问题出在免疫系统的“培育基地”——胸腺上。
胸腺是生产免疫“主力军”T细胞的关键器官,可从40岁开始,它会以每年3%的速度慢慢被脂肪替代,到70岁时,生产T细胞的能力只剩年轻时的10%。
过去,科学家尝试过用激素、重组细胞因子,甚至胸腺移植来解决问题,但是不仅副作用大,而且效果有限、难以普及。直到张锋团队找到新思路:既然胸腺的衰退难以逆转,不如找个“替代培育基地”,而肝脏恰好成了最佳选择。
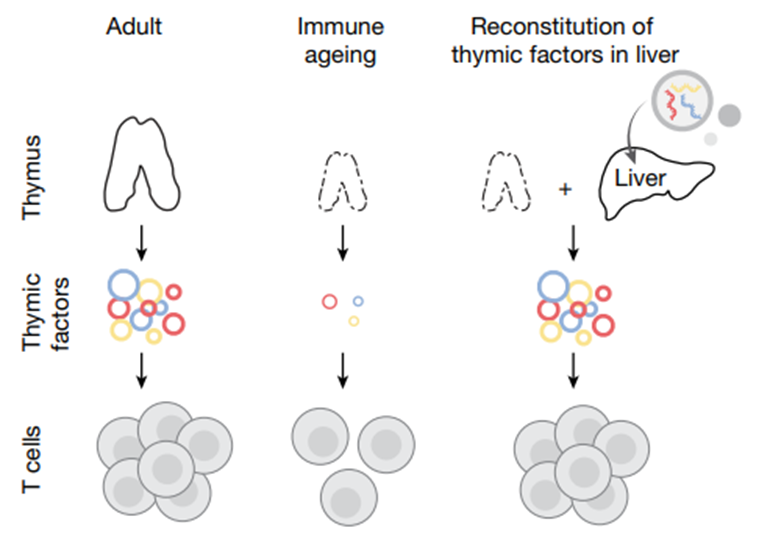
肝脏:从代谢器官到免疫调节中枢
选肝脏当“替代培育基地”,是因为它有两大天生优势:一是“生产能力”强悍,哪怕步入老年,肝脏合成蛋白质的效率依然很高,能足量产出免疫所需的 关键物质;二是“运输便利”,肝脏是全身血液的“中转站”,生产的免疫因子能顺着血管快速输送到免疫系统的各个角落。
要让肝脏精准“履职”,还得靠两项关键技术:一是“精准投递系统”脂质纳米颗粒(LNP),把编码免疫因子的mRNA包裹在里面,静脉注射后,90%以上都能精准送达肝细胞,不会跑到其他器官添乱;二是“核心免疫因子组合”(简称DFI),这是科学家通过先进技术筛选出的“免疫激活密码”——
DLL1:能引导免疫干细胞定向发育成成熟T细胞;
FLT3L:能让树突状细胞数量增多、功能强化,更快捕捉“敌人”特征;
IL-7:能延长新生T细胞的存活时间,避免其过早失调。
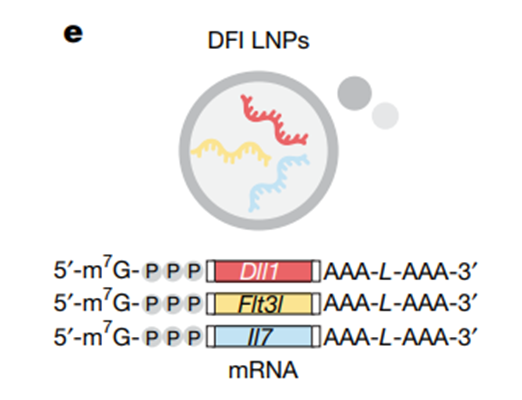
这三种因子缺一不可,单独使用效果有限,协同作用才能复刻胸腺的核心功能。更妙的是mRNA技术的特性:它不像传统药物直接输入体内,而是让肝脏按需、平稳地合成因子,避免了高剂量药物引发的炎症;而且mRNA会自然降解,不会改变肝脏的本职工作,安全又可控。
实验验证:衰老免疫真的能“逆龄”
为验证效果,研究团队用18月龄(相当于人类50多岁)的老年小鼠做实验,每周注射2次DFI mRNA,4周后就出现了明显的“免疫回春”效果:
免疫细胞“更新换代”:骨髓中的免疫前体细胞数量增加,胸腺重新恢复了批量培育T细胞的能力,血液中新生免疫细胞的数量翻倍,能识别的类型大幅增加。
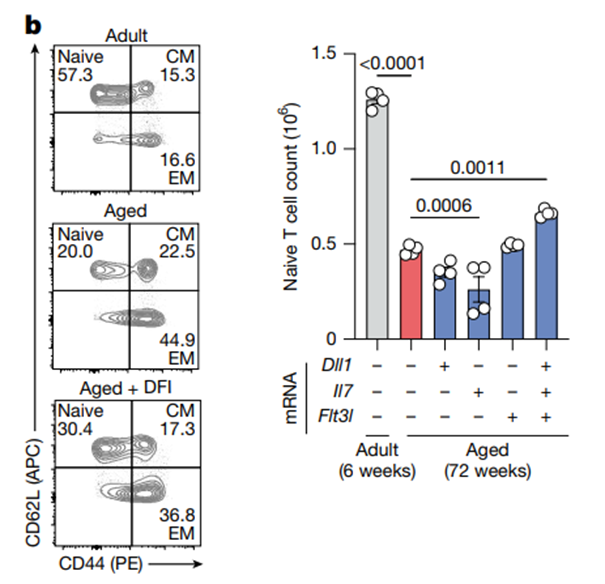
疫苗保护力显著提升:老年小鼠接种疫苗后,DFI治疗组产生的抗原特异性T细胞,比对照组多2倍,免疫应答强度接近年轻小鼠的水平。
抗肿瘤能力突破:在黑色素瘤模型中,40%的治疗小鼠实现了肿瘤完全消退;当与免疫治疗药物联用时,小鼠存活率比单独使用免疫治疗提升50%。
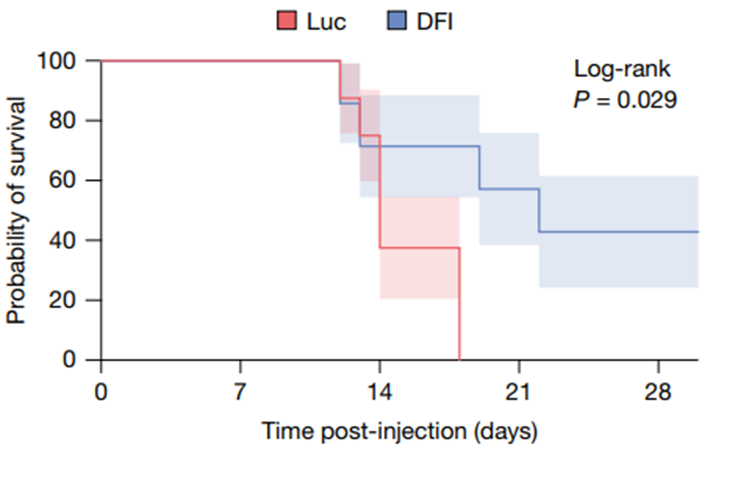
更让人放心的是安全性:实验期间,小鼠的体重、肝功能指标均正常,没有出现严重的炎症反应,停药后免疫指标也能平稳回落,不会给身体带来额外负担。
安全密码:“短暂性”才是核心优势
DFI疗法和传统疗法相比,它的优势十分突出:传统重组细胞因子治疗需要高剂量、频繁注射,容易引发全身性炎症;而DFI mRNA能让免疫因子在体内平稳释放,炎症水平与正常老年人几乎无差异。
同时,在易患糖尿病的小鼠模型中,接受治疗后6个月都未出现自身免疫疾病;即便增强了疫苗应答,也不会引发过敏或异常免疫攻击。
这种特性让它的应用场景格外灵活:流感季前注射一疗程,快速提升疫苗保护力;肿瘤免疫治疗前进行短期干预,帮免疫系统“预热”,让后续治疗效果更优,完全无需长期用药。
迈向人类应用的漫漫征途
尽管小鼠模型结果喜人,但从实验室到临床仍有长路。首先,人类胸腺退化的时间进程和机制与小鼠存在差异;其次,长期重复给药的安全性和免疫原性需要严格评估;再者,如何确定最佳的治疗窗口和剂量方案也是关键问题。
然而,这项研究揭示了一个被忽视的治疗靶点:与其费力地修复已经退化的胸腺,不如利用身体中其他功能尚好的器官来代偿性提供免疫支持。
未来,它的应用场景会不断拓展:不仅能帮助老年人提升免疫力,还能改善免疫缺陷人群的抵抗力,甚至为接受化疗、骨髓移植的患者重建免疫系统等等。我们或许会看到“定制化免疫方案”:接种疫苗前激活免疫储备,肿瘤治疗前强化免疫战力,真正实现“精准免疫调节”。
参考资料:
[1]Friedrich, M. J. et al. Transient hepatic reconstitution of trophic factors enhances aged immunity. Nature (2025) doi:10.1038/s41586-025-09873-4.
