在生物界中,许多物种展现出惊人的再生能力,其中最引人注目的要数蝾螈了,什么断臂再生、脊髓修复通通不在话下。也正是这一特性,让它成为再生医学领域研究的重要模型。月初,《Science Immunology》上的一项研究有刷新了再生医学领域的认知:科学家发现,将蝾螈的胸腺移除后,短短六十天内,一个功能完整的胸腺竟从无到有,重新生长出来[1]。

脊椎动物复杂器官从零再生
胸腺作为T细胞分化发育的核心淋巴器官,在包括人类在内的大多数脊椎动物中,其完全切除或年龄性退化通常被认为是不可逆的。然而,德国科学家对167只幼年蝾螈的实验观察打破了这一认知。研究团队在对蝾螈进行手术后第7天即观察到了胸腺原基出现,并在第35天生长至与正常胸腺相当的体积与形态。

值得注意的是,再生成功率约为60%。这个远低于其断肢再生(接近100%)的成功率,恰恰证明了该过程并非基于残余组织的简单修复,而是一次更为复杂的“从零重建”事件。
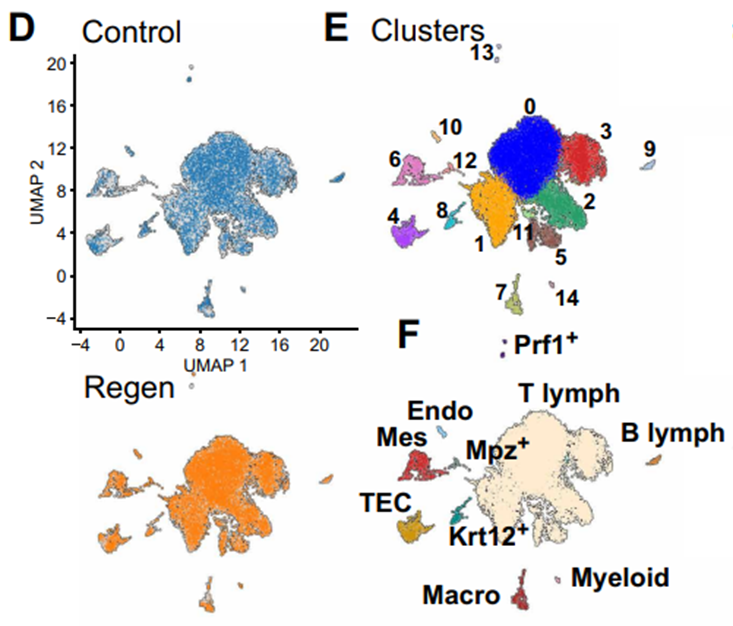
且单细胞测序分析证实,再生胸腺精确复刻了包括胸腺上皮细胞、各阶段T细胞前体、基质细胞等在内的所有关键细胞类型,其细胞组成图谱与原生胸腺几乎没有差别。这说明,再生的胸腺不仅仅只是外观复刻,还拥有行使胸腺功能的先决条件。
功能验证:再生胸腺“活”得如何?
一个器官的再生不仅仅是细胞的重新聚集,更需要功能的恢复。研究团队通过一系列实验验证了再生胸腺的功能完整性。
首先,单细胞数据表明,再生胸腺中存在着从早期胸腺祖细胞到成熟T细胞的完整发育谱系,关键发育调节因子如Hes1、Rag1和Tcf12的表达模式与正常胸腺一致。
接着,团队进行了移植实验:将再生的胸腺结节从表达荧光蛋白的蝾螈移植到白色蝾螈体内。结果令人振奋——移植后仅3天,来自再生胸腺的荧光淋巴细胞就开始出现在宿主血液中;这些细胞还能迁移到脾脏、肢体甚至正在再生的肢体芽基中。
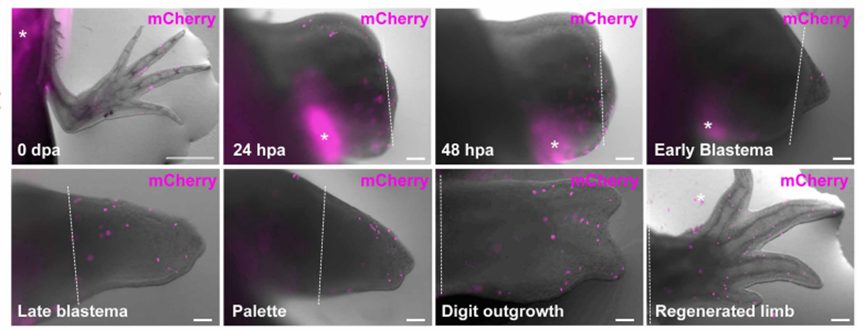
更关键的是,移植一年后检查发现,再生胸腺中唯一保留的供体来源细胞是胸腺上皮细胞,而其中的成熟淋巴细胞全部来自宿主。这意味着再生的胸腺不仅自身存活,还能够招募宿主的造血祖细胞并支持其发育为功能性T细胞。
“这表明再生胸腺保留了其关键功能:造血祖细胞招募、胸腺生成和迁移性T细胞的产生,”研究共同通讯作者勒内·马尔解释道。
分子机制:MDK信号通路的关键作用
在胸腺生物学中,FOXN1转录因子是众所周知的“主宰者”。在哺乳动物中,FOXN1对胸腺器官发生和胸腺上皮细胞身份的维持至关重要。
研究团队通过CRISPR-Cas9技术敲除了蝾螈的Foxn1基因,结果发现这些突变体的胸腺发育严重受损,结节体积只有野生型的约1/100,且成熟T细胞产生能力下降。
然而,令人惊讶的是,Foxn1敲除的蝾螈仍能启动胸腺再生——虽然再生的胸腺结节较小且功能受限,但再生发生率和结节数量与野生型相似。

这表明FOXN1在胸腺器官发生中具有保守功能,但对于胸腺原基的初始形成——无论是发育还是再生——并不是必需的。
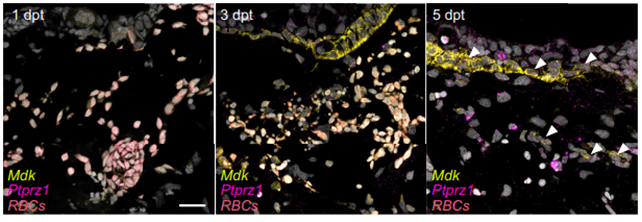
这一发现促使研究人员转向更全面的筛查。通过分析胸腺切除后不同时间点的基因表达变化,一个名为“Midkine”(MDK)的信号分子脱颖而出。
MDK是一种生长因子,在蝾螈肢体再生中已知发挥作用,但在胸腺发育或再生中的作用从未被探索。研究发现,在胸腺全切后的1-3天内,手术区域的MDK蛋白迅速升高;到第5天,MDK与其受体PTPRZ1结合。当研究人员阻断这一信号通路后,胸腺再生严重受阻,成功率大幅下降,直接证明了MDK是启动胸腺再生程序的必需信号。
更加值得注意的是,MDK介导的再生机制并不局限于胸腺。已有临床前研究表明,这一信号通路在肝脏再生、骨折愈合、甚至肢体再生中同样发挥着重要作用。
这意味着,从蝾螈胸腺再生中破解的“密码”,可能是一把能打开多种器官再生之门的通用钥匙。它为研究心脏、肾脏、肺等多个重要器官的再生修复提供了全新思路。
从实验室到临床:潜在的人类应用前景
蝾螈胸腺再生的发现,不仅仅是对这种神奇生物能力的又一次惊叹,更为人类医学带来了实质性的启示。研究表明,MDK并非蝾螈特有,在人类胚胎发育阶段同样高度活跃,只是成年后表达受限。
这说明,人类并非天生缺乏再生潜力,而是再生的遗传程序在进化过程中被“休眠”了。这一发现提出了一个激动人心的可能性:通过安全的方法重新唤醒这些沉睡的潜能。
未来,胸腺再生技术可能惠及三类人群:因疾病治疗不得不切除胸腺的患者、因年龄增长导致胸腺萎缩的中老年人,以及先天性胸腺发育不全的患儿。对他们而言,治疗思路可能从终身的免疫支持转向本源性的免疫系统重建。
墨西哥钝口螈的胸腺再生现象,为科学研究提供了一个独特的模型。通过解析其背后的细胞与分子机制,不仅有助于深化对生物再生原理的理解,也为干预人类免疫系统衰退等相关问题提供了新的潜在思路。随着对该机制研究的深入,未来或许能够为因衰老或疾病导致的免疫功能丧失,开发出基于促进再生的治疗策略。
参考资料:
[1] Czarkwiani, A., Petzold, A., Rost, F. & Yun, M. H. Molecular basis for de novo thymus regeneration in a vertebrate, the axolotl. Science Immunology 10, eadw9903 (2025).
