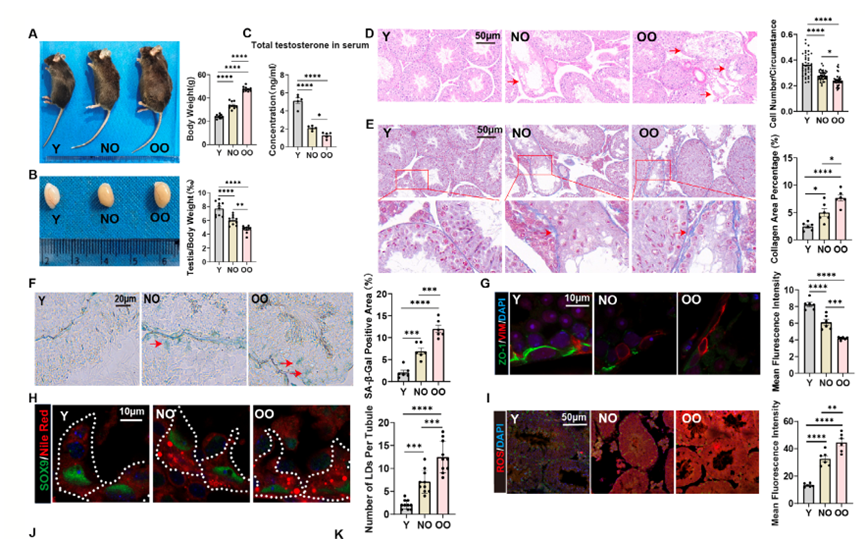
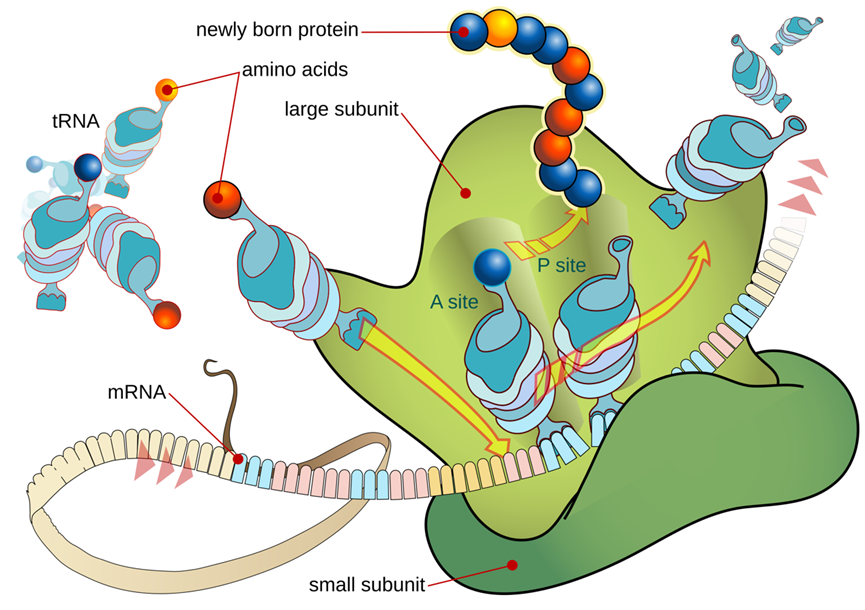
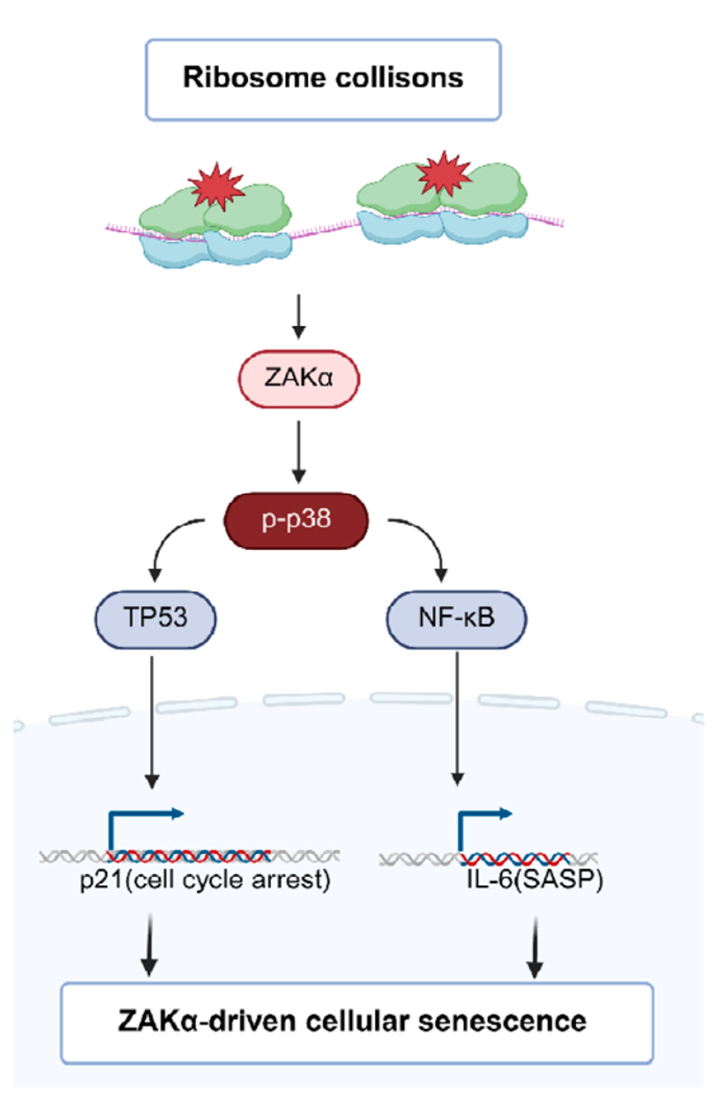
随着年纪增长,男性体能下降、肌肉变少、情绪不高,这可能都和身体里一个重要的“工厂”老化有关——这个“工厂”就是睾丸。 睾丸主要有两个任务:一是生产精子,二是生产睾酮(主要的雄性激素)。睾酮就像是男性身体的“活力激素”,它维持着肌肉力量、骨骼强度、性欲和精力。当睾丸这个“工厂”老化,睾酮产量不足,就会出现一系列所谓的“中年危机”症状。 为什么睾丸会老化?长期以来,这是个谜。近日,一项发表于《衰老·细胞》(《Aging Cell》)上的重要研究揭开了冰山一角。研究发现,问题的开端竟然是我们熟悉的脂肪。不过,这些脂肪不是长在肚子上,而是堆积在了睾丸内最关键的一种“支持细胞”里[1]。 睾丸里有一种必不可少的细胞,叫支持细胞(Sertoli cells)。你可以把它想象成精子生产车间的“管家”。 它们就像睾丸组织中的“全能管家”,既要为精子生成提供营养支持,又要构建起血睾屏障这道“防护墙”,保护生殖细胞免受外界损伤。 科学家发现,在老化的睾丸里,这些“管家细胞”内部堆满了小小的脂滴,也就是细胞储存的脂肪颗粒。 在正常细胞里,脂滴是“能量储备”。但在支持细胞这种不该大量储存脂肪的地方,过多的脂滴就成了代谢负担。 实验证明了这一点,中山大学研究团队构建了三组实验小鼠模型:2月龄的年轻对照组、20月龄的自然衰老组和20月龄的肥胖老年组。结果显示:和年轻小鼠相比,老年小鼠的睾丸萎缩,睾酮下降。更关键的是,肥胖老年组小鼠的支持细胞中,脂滴积累和活性氧(ROS)水平均显著高于其他两组,这直接表明脂肪堆积、氧化损伤和睾丸衰老紧密相关,而肥胖会成为加速这一过程的“催化剂”。 为验证脂滴堆积在支持细胞衰老中的核心作用,研究团队在体外构建了六种支持细胞衰老模型。通过基因测序和表型分析发现,棕榈酸诱导的脂滴堆积模型与自然衰老的支持细胞在基因表达模式和功能特征上高度吻合——不仅出现了明显的脂滴堆积,还完美复刻了线粒体功能障碍、细胞增殖能力下降、吞噬功能受损等所有衰老特征。 这一结果明确证实,脂滴堆积是驱动支持细胞衰老的核心因素。 科学家们进一步的机制研究,勾勒出了一条清晰的“睾丸衰老链条”: 过量的脂滴会给线粒体带来巨大压力。线粒体作为细胞的“能量工厂”,负责将营养物质转化为细胞所需的能量。当脂滴过多时,线粒体的脂肪分解能力达到极限,导致大量未被分解的脂肪酸溢出,进而破坏线粒体的结构和功能。 线粒体功能障碍后,不仅无法有效产生能量,还会产生大量的“代谢垃圾”——活性氧(ROS)。这些ROS是带有未配对电子的分子,性质极其活泼,会在细胞内四处破坏,攻击蛋白质、核酸等重要生物分子。研究发现,脂滴堆积的支持细胞中,ROS水平显著升高,且这些ROS主要来自功能受损的线粒体。 令人意外的是,这些ROS并没有直接攻击DNA,而是瞄准了细胞的“蛋白质生产车间”——核糖体。核糖体的核心功能是将mRNA携带的遗传信息翻译成蛋白质,正常情况下,它们会沿着mRNA模板有序移动,高效完成蛋白质合成。 研究团队通过核糖体图谱分析(Ribo-seq)和双核糖体测序(Disome-seq)证实,核糖体碰撞事件显著增加,表现为双核糖体(由两个堆叠的核糖体形成)的数量大幅上升。 核糖体碰撞作为一种重要的应激信号,会激活细胞内一种名为ZAKα的蛋白质激酶。ZAKα一旦被激活,就会启动下游的p38信号通路,进而激活TP53/NF-κB等下游信号网络。此外,ZAKα-p38通路的持续激活还会破坏血睾屏障的完整性,导致生产精子的核心区域失去保护,最终引发睾丸整体功能衰退。 就这样,从多余的脂肪开始,一步步引发了细胞线粒体的彻底停工和睾丸功能的衰退。 整个过程中,最关键的靶点无疑是ZAKα。如果能关掉它,是不是就能暂停衰老程序?答案是肯定的。 研究团队将目光聚焦于ZAKα抑制剂——尼洛替尼(Nilotinib)。尼洛替尼原本是用于治疗慢性粒细胞白血病的药物,其安全性已得到临床验证,这为其“老药新用”提供了重要基础。 研究者在细胞和动物层面中进行了验证。他们发现:在培养皿中,用脂肪催老的细胞,加入尼洛替尼后,衰老迹象被逆转,细胞重新恢复活力。 而在给老年小鼠使用尼洛替尼数周后,老年小鼠出现睾丸重量和睾酮水平回升,睾丸结构得到了修复,关键细胞数量增加。除此之外,小鼠的整体活力,包括生殖行为,都有所改善。 这表明,针对这条新发现的通路进行药物干预,有可能延缓甚至部分逆转睾丸的衰老过程。此外,早期使用抗氧化剂(如NAC)清除ROS,也能起到保护作用。 这项研究的科学价值不仅在于揭示了睾丸衰老的全新分子机制,更在于建立了脂代谢紊乱、氧化应激、核糖体功能障碍与细胞衰老之间的内在联系。 它不仅让我们更科学地理解男性的衰老机制,更重要的是指出了一个明确的干预靶点——抑制ZAKα,这为逆转睾丸衰老带来了直接希望。 像尼洛替尼这样的现有药物,为未来开发男性生殖衰老疗法提供了新思路。但是,将抗癌药作为衰老干预的药物并不是一个可行的措施,像雷帕霉素、曲美替尼等药物,它们都展现出了卓越的延寿抗衰效应,但是价格昂贵不说,还有不小的副作用。 因此,我们的应对策略可以集中在两个层面: 一些经过临床验证、安全性更高的强抗氧化剂(如α-硫辛酸),因其在对抗氧化应激、支持男性生殖健康方面的作用,成为了当下更值得关注的现实选择。 同时,研究从根源提示我们,控制体重、避免肥胖、保持健康饮食,是保护睾丸功能、延缓此类衰老进程最基础且至关重要的手段。 虽然从实验室到临床应用仍有长路要走,但这项发现无疑点亮了一盏灯,让我们知道该朝哪个方向努力,才能更好地维护男性健康与活力。这既需要仰望未来科学的突破,也完全可以凭借今天已有的知识和工具,从生活点滴开始行动。
睾丸衰老的核心特征:支持细胞被脂肪“填满”
脂滴堆积如何触发支持细胞衰老?一条清晰的“致病链条”
第一步:脂滴超载导致线粒体“罢工”
第二步:线粒体“罢工”产生大量活性氧(ROS )
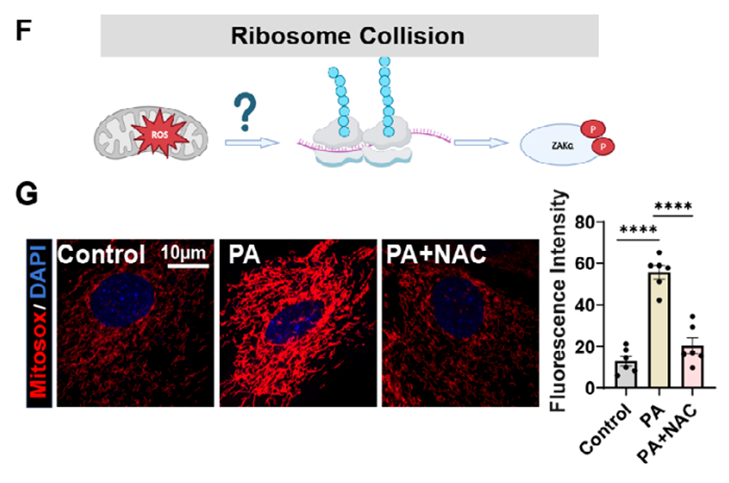
第三步:ROS攻击核糖体引发“交通堵塞”
第四步:碰撞激活“衰老信号通路”,锁定细胞衰老状态
老药带来新希望:ZAKα抑制剂为延缓睾丸衰老提供新方案
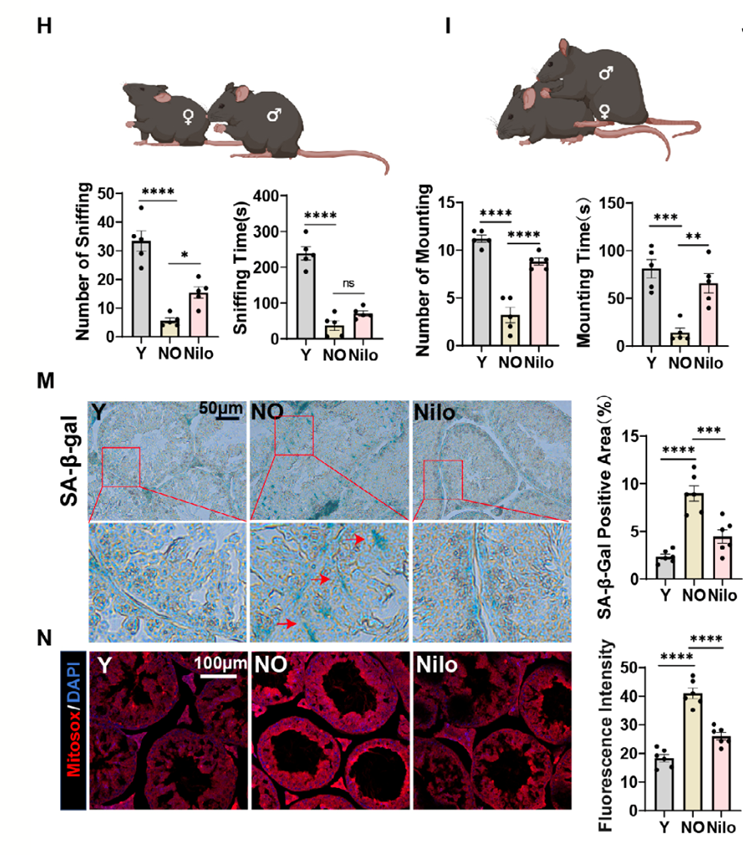
除了抗癌药,是否还有其他更安全、更可行的选择?
1、功能补充剂:
2、生活方式干预:
参考资料: [1] Xu, Y. et al. Lipid Droplet‐Driven ribosome collisions trigger ZAKΑ ‐P38 signaling to accelerate testicular aging. Aging Cell 25, e70359 (2026).
