长寿之家Changshou.com会定期帮助大家挑选优秀内容,掌握衰老干预领域新进展。本文转载自药明康德旗下公众号学术经纬(微信号:Global_Academia)。
编辑导读:CAR-T疗法作为近年来的明星疗法,针对不同病症的研究层出不穷,甚至还有体内CAR-T疗法即将进入临床。本篇文章介绍了该疗法的两个全新研究进展。
根据世界卫生组织(WHO)和其他健康统计机构的数据,心血管疾病已连续多年成为全世界头号死因,每33秒就会夺去一个人的生命。
要防范和治疗心血管疾病,就不能不了解低密度脂蛋白(LDL)。正如美国国立卫生研究院(NIH)的脂蛋白研究专家Alan Remaley博士所指出的,低密度脂蛋白是心血管疾病的主要诱因。
血液中的LDL负责把胆固醇运送到身体组织,如果LDL水平偏高,就意味着LDL运送的胆固醇很容易在动脉壁内沉积。久而久之,血管壁变厚、硬化、失去弹性,进而阻碍血流,这个变化就是我们常听到的动脉粥样硬化。动脉粥样硬化正是心血管疾病的主要病理基础。这也是为什么低密度脂蛋白胆固醇(LDL-C)常被称为“坏胆固醇”。
本周,顶尖学术期刊《自然》“背靠背”发表了两篇论文,对于“坏胆固醇”如何在体内聚积的理解有了重要突破。科学家们利用先进的冷冻电镜技术,结合2024年诺贝尔化学奖获奖技术——人工智能(AI)驱动的蛋白质预测技术,前所未有地看清了低密度脂蛋白的核心成分——载脂蛋白B(apoB100)的结构,首次揭示了apoB100如何与低密度脂蛋白受体(LRLR)结合,正是这一结合启动了将LDL从血液中清除的过程。
研究者指出,此次的新发现不仅有助于理解低密度脂蛋白为何会导致心血管疾病,还打开了个体化降脂疗法的大门,将指导开发更有效地清除“坏胆固醇”的新疗法。

载脂蛋白B(apoB100)由肝脏分泌,是低密度脂蛋白的主要结构和功能成分,也是人类基因组中最大的蛋白质之一,分子量约550kDa,巨大的体积和复杂的脂质关联结构一度给解析其结构带来了重大挑战。
密苏里大学(University of Missouri)的研究者综合运用冷冻电镜、预测蛋白结构的AI平台AlphaFold2、基于分子动力学的细化方法等,展示了首个apoB100结构,且大部分区域分辨率达到亚纳米级。
根据作者的描述,apoB100由一个大的球状N端结构域与一段长约61nm的两亲性β折叠结构组成,后者像腰带一样缠绕在LDL颗粒周围。β折叠结构的两侧近似对称地分布着9段链间插入物,横跨脂质表面,提供额外的结构支持。通过这些结构信息,可以解释apoB100的各个结构域如何在不同粒径范围内协同作用,从而保持低密度脂蛋白的形状和内聚力。
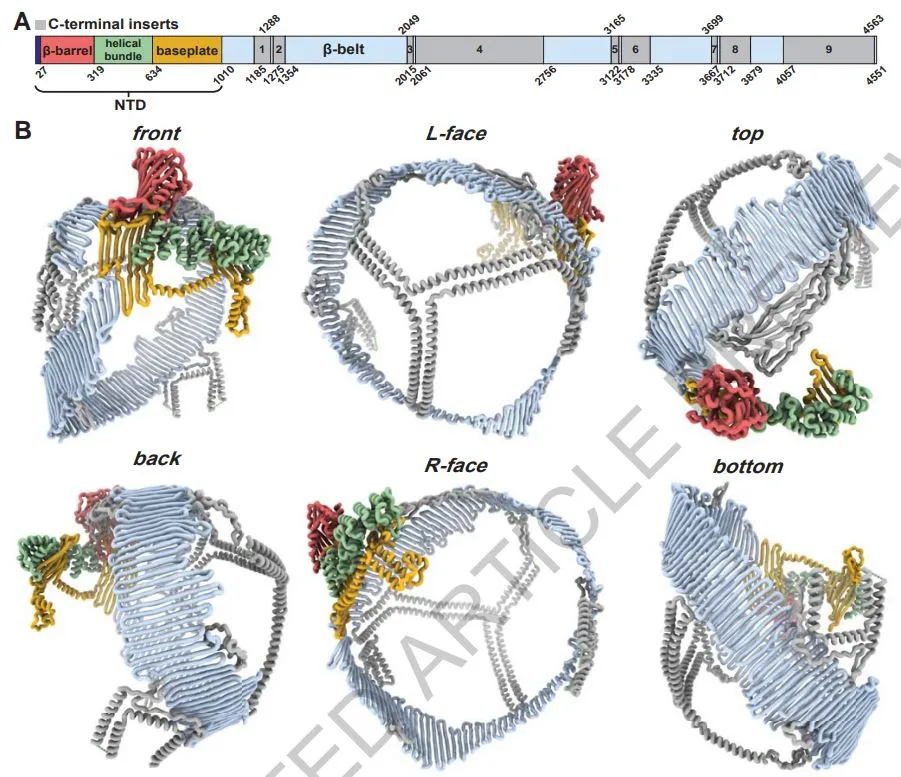
另一篇论文则侧重于apoB100与受体LDLR结合的整体结构,这个结构对于理解如何降低LDL-C水平至关重要。因为通常情况下,只有当apoB100与LDLR结合,才会启动LDL清除过程。但在基因突变导致的家族性高胆固醇血症情况下,发生在LDLR或apoB100上的突变会破坏LDLR介导的LDL清除过程,导致患者体内LDL水平高出寻常,往往在年轻时就发展出心血管疾病。

这项研究同样综合运用了单颗粒冷冻电镜技术和蛋白质结构预测模型,重建出apoB100与LDLR相结合时的结构,发现apoB100上有两个不同的界面与LDLR结合,这两个连接界面参与了LDL二聚化的形成,以及LDL如何在不同构象之间转换。
通过局部细化,研究者进一步确定了这两个连接界面的高分辨率结构,发现与家族性高胆固醇血症有关的基因突变几乎都出现在apoB100与LDLR连接的位置。

这些发现为理解LDL如何清除提供了重要信息,对心血管疾病的发病机制和治疗都有广泛的意义。 一方面,这些发现有助于研发新的靶向疗法,纠正由基因突变引起的功能障碍;此外,研究人员认为更重要的是,对于那些没有基因突变但胆固醇偏高的患者,在此次新发现的基础下,也有望诞生更有效的疗法。
因为现有的很多降脂疗法,例如他汀类药物,通过刺激LDLR的增加来降低LDL-C,而通过精确了解LDLR与LDL的结合位置和结合方式,未来可以瞄准这些连接点设计出新的疗法,克服现有药物在耐受性、依从性等方面的瓶颈,给患者提供更多的选择,达到其LDL-C目标值。
参考资料:
[1] Zachary T. Berndsen & C. Keith Cassidy The structure of apolipoprotein B100 from human low-density lipoprotein. Nature (2024)
[2] Mart Reimund et al., Structure of apolipoprotein B100 bound to the low-density lipoprotein receptor. Nature (2024)
[3] NIH research reveals new insights about how 'bad' cholesterol works in the body Retrieved Dec. 12, 2024 from
