“长寿药”已经是现实了。
这绝对不是危言耸听,21世纪以来,生命科学领域对于“我们为什么会衰老”的原因已经基本达成共识。
我们的寿命和什么有关?如果你简单查看WHO公布的《2025年世界卫生统计报告》,就不难看出,近20年间,世界平均预期寿命提升了6.5年之久。但原本向上的趋势在2019年又下滑——肆虐3年的全球疫情让人均寿命水平回到了13年前的水平。
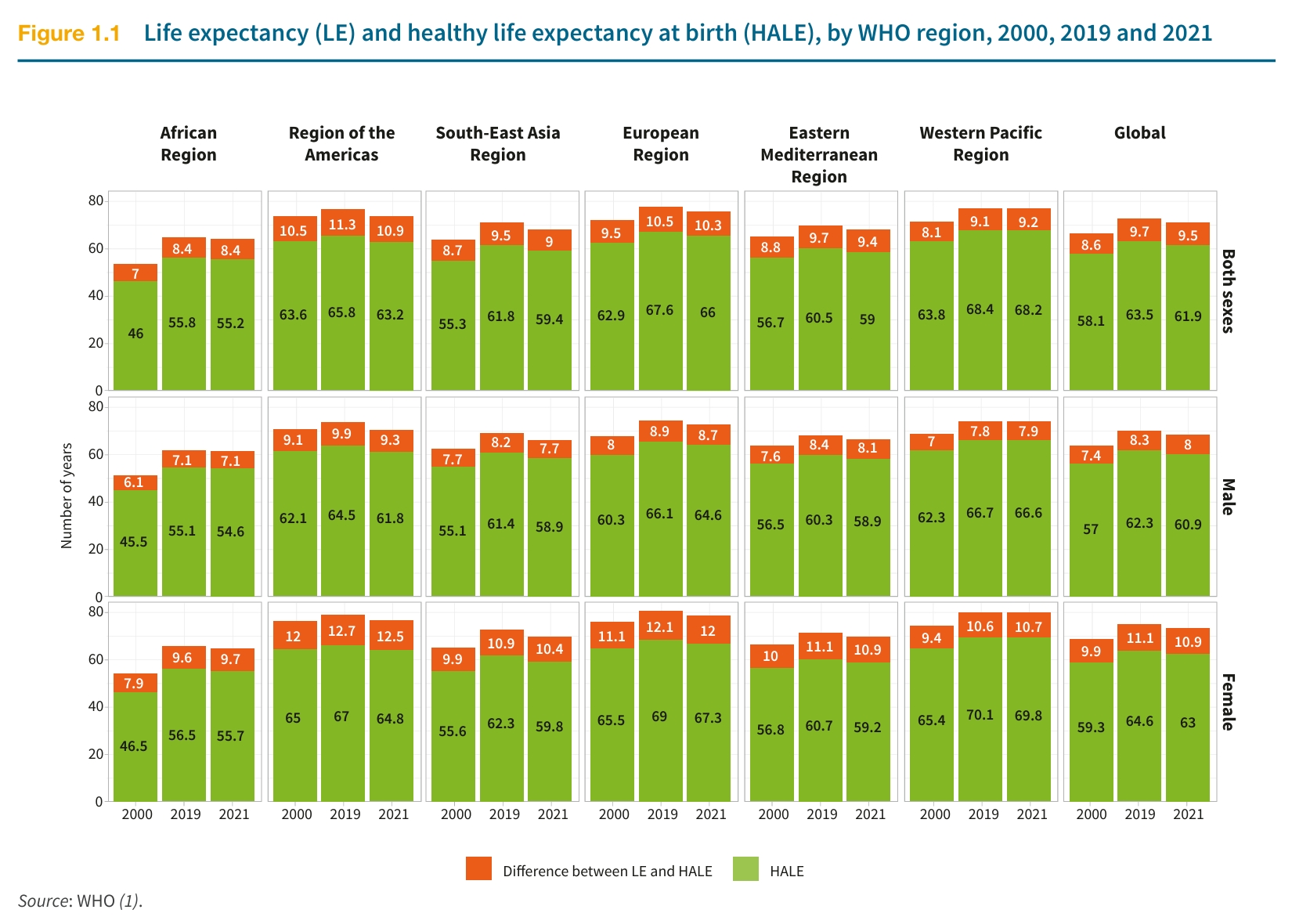
这组数据还告诉我们另一件事:“预期寿命”(life expectancy)是和国家繁荣程度、医疗水平高度挂钩的。当医疗水平有显著提升时,全民预期寿命也会飞速提升。但这也带来了另一个问题:
人类的预期寿命有尽头吗?有,但这件事并非坏事。
2024年10月,伊利诺伊大学芝加哥分校的奥尔尚斯基(S. Jay Olshansky)团队在《自然·衰老》(Nature Aging)上的研究给出了一个可能的答案:从1990年到2019年,全球寿命增长的速度逐渐放缓,活到100岁的几率远没有我们想象的那么高[1]。
这里我想请你思考一个问题:对于老人来说,是躺在病床上30年更好,还是享受20年健康晚年更妙?

我认为,没有人会选前者。
优质的晚年生活对于当代社会来说意义重大。正因如此,世界卫生组织于2001年提出了“健康寿命”(HALE)这个说法。也有人认为,如何提升人类的健康寿命,将会是“第二次长寿革命”的重点。
在今年的两会上,著名主持人白岩松也指出,相比关注人均预期寿命,未来我们更应该关注的是“健康寿命”。
那究竟要怎么做?
我们为什么会衰老
想要干预衰老,就需要先了解衰老。长寿科学在21世纪以来,进展飞速,学界对“人类为何会衰老”已经有了明确的结论[2]。
2013年,López-Otín等人首先在Cell上发表了“衰老的九大标志”,在10年后的2023年,他们将九大标志更新为十二大标志——基因组不稳定、端粒损耗、表观遗传学改变、蛋白稳定的丧失、大自噬功能的失效、营养感应失调、线粒体功能障碍、细胞衰老、干细胞衰竭、细胞间通讯改变、慢性炎症和菌群失调。
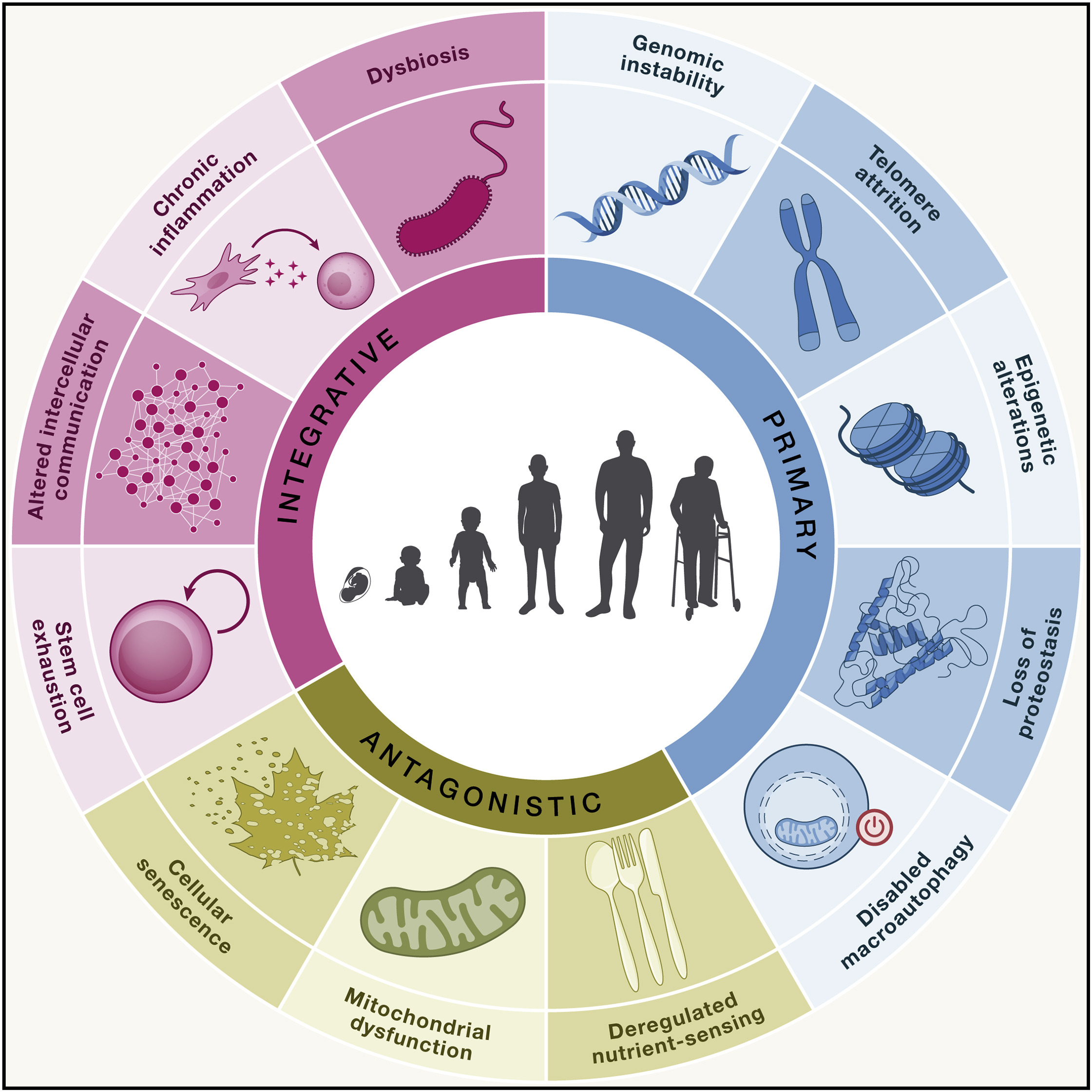
目前,一切干预手段都与这12大衰老标志相对应。有针对其中单个标志的,也有同时针对多个标志的。
有什么可行的干预手段?
在衰老研究中,如何“延缓衰老”显然是研究的重点之一。但在具体讨论方法之前,我们需要先明确一个事实:我们想讨论的是哪种“延缓衰老”,或者说怎么去“延缓衰老”?
通常来说,延长预期寿命有两个主要策略:
1. 通过降低特定疾病、特定行为的发生率,降低因疾病或者特定行为所导致的全因死亡率。所以在这个背景下,少喝酒和避免在公路上超速行驶本质上是一样的——他们都会增加你的死亡风险;
2. 通过干预衰老标志来延长寿命。这也正是我们想讨论的点,因为当“物质极大丰富”时,如何“逆天改命”,或者说从更底层的路径上进行干预,才能解决根本问题。
方案1固然重要,但对于已经拥有良好医疗条件,以及遵循健康生活方式的人来说,如何突破“生理极限”就更需要方案2的参与。
较为主流且被广泛研究的衰老干预方法
热量限制
目前开展最广泛、研究最深刻的办法是“禁食”——专业说法叫“热量限制”。简单来说,就是通过限制每日的热量摄入,让身体模拟一种“保存能量”的状态,并达到延长存活时间的最终目的。
热量限制一直是延寿领域的热门话题,几乎每年都有不同的研究可以证明在不同的模式动物中延长寿命。近年最有名的是2024年谷歌旗下公司Calico的一项实验,涉及近千只小鼠[3]。在这项研究中,热量限制最多的小鼠,比不限制饮食的小鼠要长寿将近四成。
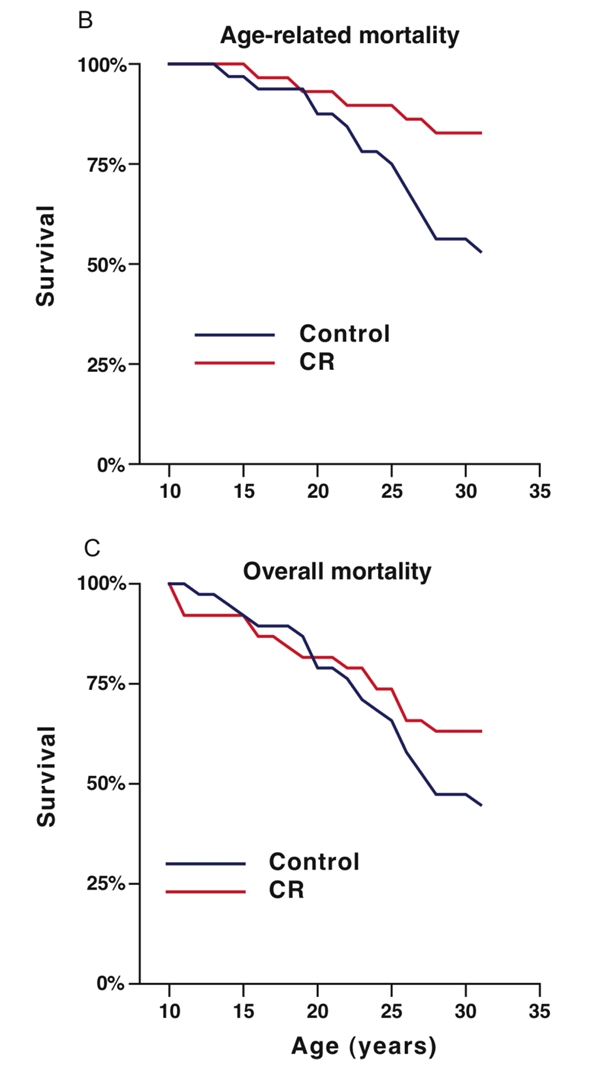
除了小鼠外,热量限制领域最有名的实验是一项在灵长类中开展的实验。美国国家衰老研究所NIA和威斯康辛大学麦迪逊分校(UW-Madison)曾在1980年代共同开展基于恒河猴的热量限制实验,并持续了长达30年之久。这项研究不但耗时数十年,同时也斥资数百万美元。
在UW的研究中[4],热量限制的猴子寿命和晚年生活质量都得到了显著提升,这样的区别甚至可以从外表上区分出来(C、D为热量限制猴)。
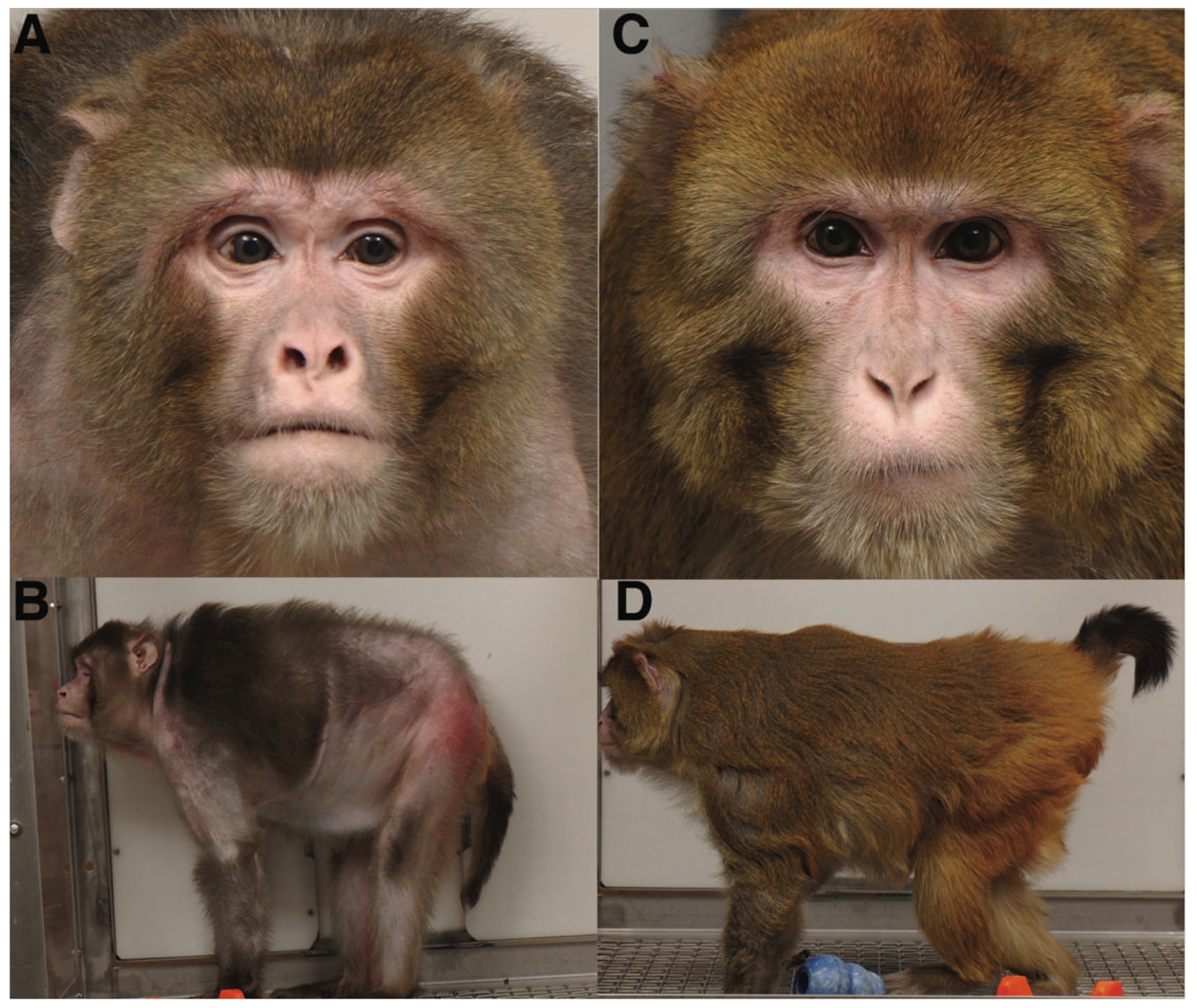
这项跨越年代的研究基本证实了热量限制可以针对多项衰老标志产生效果,并最终达到寿命延长的目的。
在人类领域中,针对“16+8”或“5+2”禁食的相关研究也非常丰富[5]。目前看来,有效应用禁食疗法,对受试者的体重、代谢功能、肌肉能力等相关指标都有提升。
mTOR通路——欺骗身体的秘密开关
在上述大部分研究中,实验动物禁食的比例一般是在40%左右——这个比例对于人来说其实非常困难。而且如果单纯为了长寿,而失去了生活乐趣,也并非妙计。
所以科学家将思路投向了热量限制研究中的一个重要靶点:mTOR通路。
mTOR全称是哺乳动物雷帕霉素标靶蛋白,主要功能是调节细胞生长和调控新陈代谢。可以类比为一种细胞里的智能芯片——通过感知细胞的营养状态,来决定接下来要增殖、休养生息,还是自我毁灭(自噬)[6]。
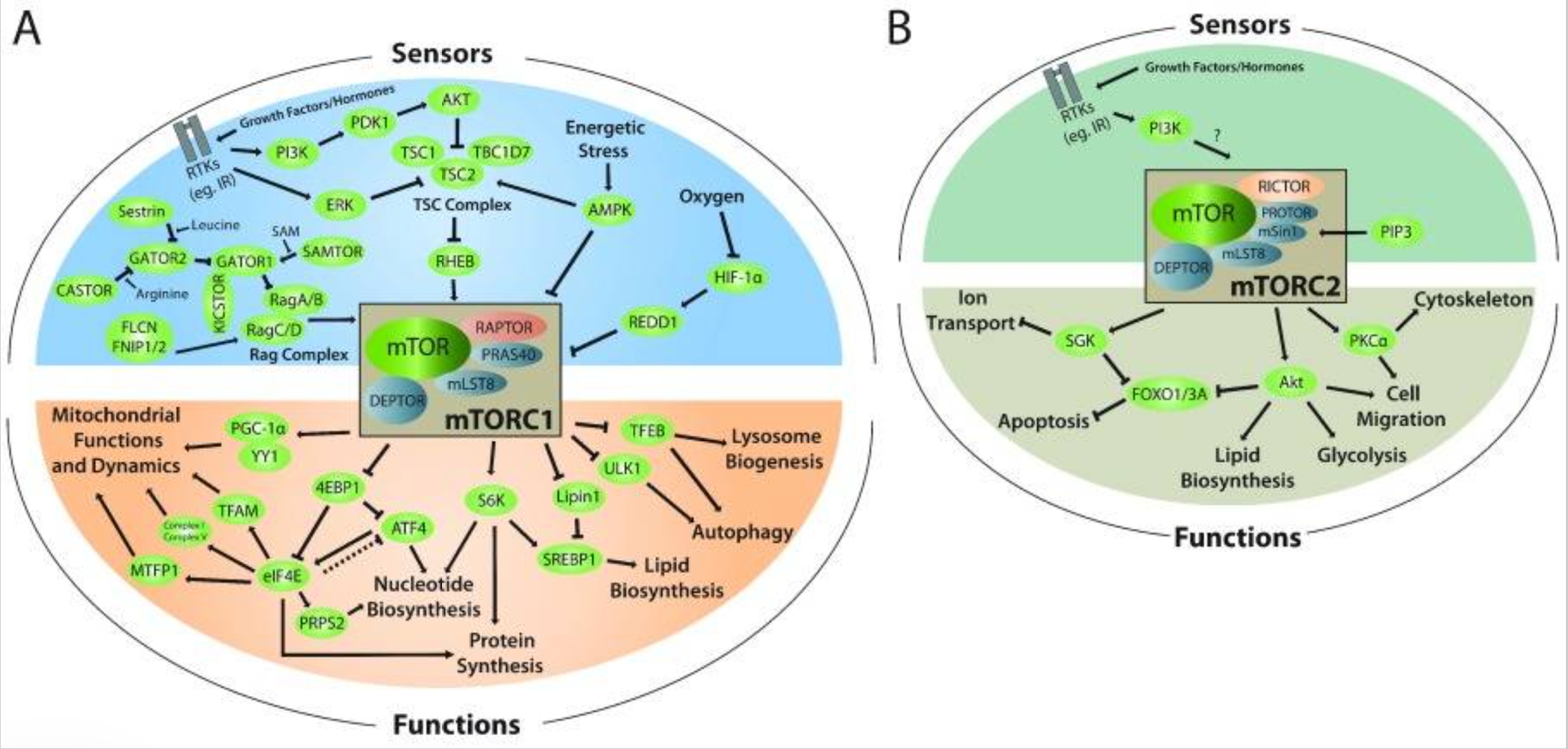
当细胞营养过剩时,mTOR通路被激活——相关通路的蛋白会刺激细胞生长,抑制细胞自噬。
当营养物质缺乏时,mTOR通路受到抑制——AMPK(腺苷酸活化蛋白激酶)磷酸化,抑制mTORC1(mTOR复合物的其中一个)活性,细胞开始停止生长,启动自噬程序。
早在2001年,科学家就发现,抑制mTOR能延长非脊椎动物的寿命。20多年来,科学家依次在酵母、线虫、果蝇、小鼠、灵长类中都观察到同样的结论:抑制mTOR就可以显著提升寿命与健康寿命[7]。
上文提到的“热量限制延寿法”背后的核心也是为了抑制mTOR的活性。于是科学家就想出一个思路:能不能找到抑制mTOR通路上的一些关键节点,再施以一些干预分子,就能欺骗我们的身体,让身体觉得“我们处在一个能量不足的状态”,最终起到延寿的作用。
首当其冲的分子自然是雷帕霉素。但雷帕霉素作为一种免疫抑制剂,对健康人有一些副作用——比如腹泻、肾功能异常、呼吸系统失调和胰岛素敏感下降等。

我们并不想要这样的副作用。长寿网红布莱恩·约翰逊(Bryan Johnson)作为“先驱者”,也是在被这些副作用困扰后停掉了雷帕霉素。
于是科学家在尝试新的方法,包括使用西罗莫司(雷帕霉素的药品名)的异构体依维莫司*,或者选择一些源自自然界的天然分子。他们或许不直接作用于mTORC1,但可能会通过其他轴线上的机制起到抑制mTOR的结果,从而达到延寿的目的。
糖代谢和AMPK激动剂
无论是禁食还是mTOR抑制,都和代谢路径有着千丝万缕的联系,这也对应上了“衰老12大标志”中的多条路径。
所以,科学家们就将视野投向了那些和代谢相关的成熟药物中,其中最重要的一种药物就是二甲双胍。这种使用了数十年的降糖神药,如今又有了进一步“封神”的机会。
2024年,中科院刘光慧团队在灵长类食蟹猴中进行了长达1200天的干预实验,他们发现接受二甲双胍治疗的猴子出现了很多衰老减慢的迹象,而二甲双胍治疗还足以让猴子大脑的“生物年龄”减少大约6岁[8]。
相比其他的降糖药,二甲双胍的作用机制非常特殊,因为它直接改变了细胞的能量平衡,就会对细胞的整个生存策略造成更多的影响。
二甲双胍具体是通过激活AMPK来实现改变能量代谢的。AMPK的激活还可以影响细胞生长、细胞自噬、炎症等诸多过程,产生广泛的调节作用。这些调节作用与癌症、神经病变等疾病都存在关联。
除了灵长类外,二甲双胍针对小鼠的延寿实验非常成熟。NIA著名的ITP(衰老干预测试计划)中,将二甲双胍和雷帕霉素联合使用可以延长所有性别小鼠的最大和中位数寿命,可以说是效果显著。
未来,一些新的临床试验将进一步对二甲双胍的抗衰老能力进行验证。例如TAME(Targeting Aging with Metformin)试验,这项研究计划纳入3000名受试者,进行长达6年的测试。等到更多临床证据出炉后,二甲双胍或许能够作为衰老干预药物正式被认可,为更多人带来健康与长寿。
NAD+与长寿蛋白
代谢的核心是细胞对能量的利用,我们在上文中已经多次提到这一点。这其实可以尝试从演化上来进行解释。演化生物学家理查德·道金斯(Richard Dawkins)在《自私的基因》中提出过一种理论,认为一个物种的最终目的是将自己的基因更多的传给整个群体。
更夸张一点的说,就是“我们的身体只是基因的传播机器”。于是就会出现这样一种现象——当你不再具备生育能力时,身体就会快速走向衰老。这件事在女性更年期上体现的尤为显著,我们每个人都曾经目睹过妈妈在更年期后日渐憔悴的心酸过程。

这个过程背后是否有一个统一的、可以一劳永逸的靶点或分子?哈佛医学院的大卫·辛克莱尔(David Sinclair)提出了一种可能。
辛克莱尔把自己的目标聚集在了一种叫做NAD+的分子上,NAD+也叫辅酶I,它并非一种新发现的物质。在此前的理解中,NAD+是一种在细胞代谢途径中必须用到的辅酶,所谓辅酶,就是一种辅助生物酶参与生化反应的物质。
简单类比的话,可以认为是一种“必须的燃油添加剂”——细胞通过燃烧燃料获取能量(ATP),为了完成这个过程,就必须需要NAD+的参与。
辛克莱尔在研究中发现,随着年龄的不断增长,生物体内的NAD+水平会逐年降低,同时会造成线粒体功能障碍,进而在多个层面加速机体衰老[9]。这项结果于2013年发表在全球顶级刊物《细胞》上。
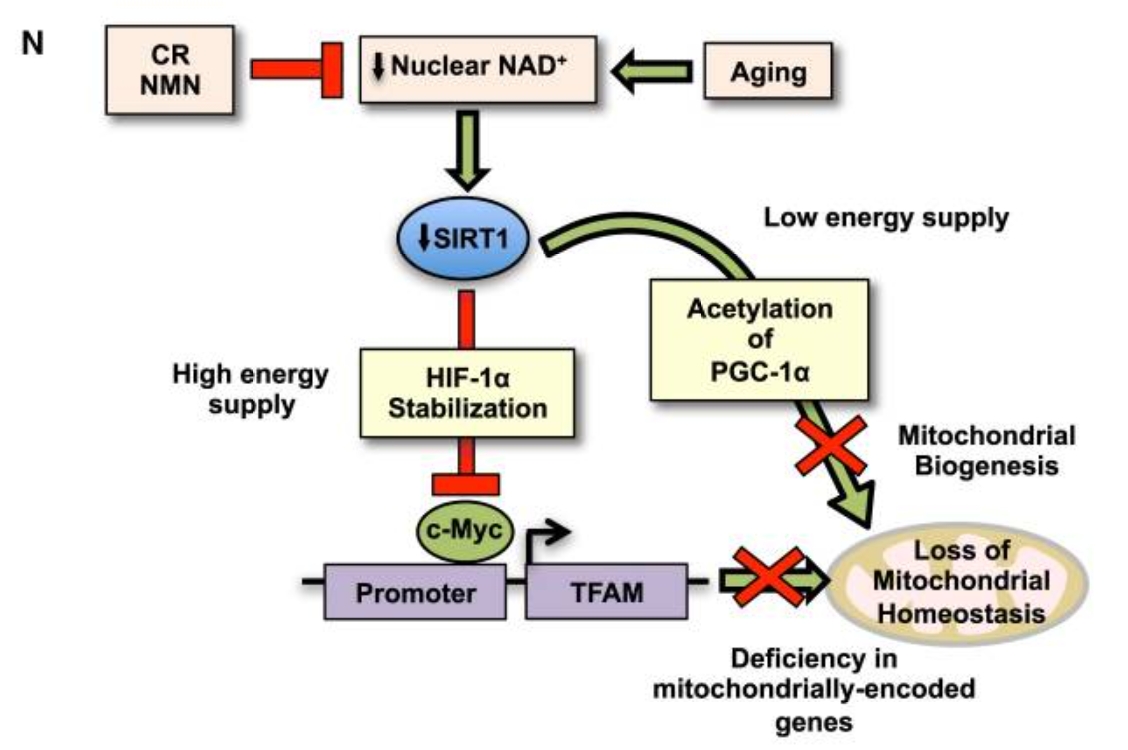
在随后的研究中,包括辛克莱尔在内的许多研究人员都发现,NAD+ 水平提升可以改善老年小鼠的线粒体功能和骨骼肌健康状况,最终达到延长寿命的目的[10]。
既然这么神奇,我们是不是直接服用NAD+就可以了?虽然作为一种体内存在的天然物质,NAD+确实比上述我们提到的雷帕霉素、二甲双胍都要安全。但NAD+的问题是,分子比较大,很难直接通过口服被肠道吸收。
所以以辛克莱尔为首的研究者就在NAD+的体内合成途径上找到了两个前体物质NMN和NR。经过一系列的实验,他们发现NMN和NR作为NAD+的前体,补充后可以将NAD+恢复到年轻水平,从而恢复体内NAD+依赖性酶的功能[11],如Sirtuins、CD38等。
目前,针对NAD+提升的研究正在广泛开展,研究者也在临床试验中发现了许多提升NAD+的好处,像是减缓骨骼肌衰老、提高跑步耐力、改善血糖水平、增强胰岛素敏感性和心血管健康、恢复衰老肌肉功能和力量、改善学习记忆能力等[12]。
在NAD+的代谢路径中,还有一个重要的参与者,就是被誉为“长寿蛋白”的Sirtuins家族,也经常被缩写为SIRT蛋白。其实这背后是一系列蛋白的总称,它们是一种“去乙酰化酶”,在许多物种中,人们都发现SIRT蛋白比较活跃的个体,往往更加长寿。
为什么?辛克莱尔提出,这可能与“表观遗传”有关——表观遗传是一种非遗传的基因修饰,简单来说,基因就像是菜谱,而表观遗传则是厨师。在衰老过程中,菜谱还是那些步骤,但厨师可能力不从心,做出来的菜自然就会越来越不好吃。
这个力不从心的过程,就是表观遗传改变的过程。同时,来自中科院的刘光慧、曲静和张维绮也在近年来提出很多SIRT蛋白通过调控能量代谢影响衰老进程的研究[13],进一步提升了SIRT蛋白在衰老干预进程中的重要性。
那有什么办法提升它的活性吗?除了刚才我们提到的,提升SIRT蛋白家族必须的辅酶NAD+之外,科学家还发现了一些专门的SIRT提升分子,如白藜芦醇、人参皂苷等等[14]。
但万变不离其宗,2025年以来,新研究也揭示,像是麦角硫因这样的许多热门分子,都是通过NAD+来干预衰老的。
至于它是否是最终解药,自然还需要更长久的观察与研究。但目前来看,没有比NAD+更接近真相的分子了。
神奇的希诺裂
俗话说,亡羊补牢,为时不晚。在衰老干预研究中,有一个非常直球的思路:既然细胞衰老不好,那我们干脆就直接干掉它们?
这就是希诺裂(衰老细胞清除剂,Senolytics),这个概念最早源自梅奥诊所的詹姆斯·柯克兰(James Kirkland)。柯克兰在研究中发现,有一些细胞会变成一种特定的“衰老细胞”,它们会分泌一种叫做“衰老细胞分泌型(SASP)” 的有害物质,这些物质会促进机体炎症,造成胰岛素抵抗等有害结果[15]。

于是,柯克兰的团队发现,一种叫做槲皮素的天然物质,如果和达沙替尼联合使用(D+Q),就可以定向清除这些衰老细胞,逆转衰老,恢复实验动物的青春[16]。这些可以定向清除衰老细胞的物质,就被命名为希诺裂。
目前,很多不同的研究团队都在探索不同的药物组合,像是漆黄素(fisetin)、BCl-2抑制剂等分子都有望成为高效希诺裂分子。
为什么长寿研究到动物实验就结束了?
这个问题看似很难回答,但其实很简单——因为人类真的很长寿。
在文章开头,我们已经提到,如今全球平均预期寿命已经达到7字头,而影响人类预期寿命的因素非常多。
为了更精准地找到“最能延长寿命”的物质,科学家首先需要通过小鼠来开展实验。小鼠作为使用最广泛的模式动物,在衰老研究中同样十分重要。
其中规模最大、最权威的衰老物质筛选计划,要数美国国家衰老研究所(NIA)于2002年启动的ITP(衰老干预测试计划)。该计划旨在通过测试多种药物对小鼠寿命的影响,寻找潜在的衰老干预措施。
他们选择了一种野生型的小鼠,这种小鼠不同于其他很多衰老研究中使用的有特定缺陷的品系,它们更具有普适性与一般性。这种小鼠的中位寿命在700-900天不等,终点数据获得通常需要 5.5 年。
这个时间是什么概念?一般一个博士也就读5-6年。对于灵长类的模式动物来说,这个时间变得更为夸张——上文提到UW和NIA的恒河猴热量限制实验做了30年,而刘光慧的二甲双胍食蟹猴研究也持续了12年之久。
对于实验成本来说,一只猴子更是一只小鼠的数百倍之多。这一切还都是考虑到,实验动物是100%听话的。
在人这里,就完全不一样了。
2025年哈佛大学营养学大牛胡丙长经过长达30年的随访调查,从10万人的餐桌上得出了一系列有关长寿饮食的结论[17]。但如果你仔细看的话,就发现他们是通过食物频率问卷(FFQ)这个模式,每两年一次进行追踪的。
这个模式在营养学研究中当然很常见,但每两年问一次“你过去两年经常吃什么”这个逻辑,在衰老干预相关的临床实验设计上就很难进行。
就算有科学家可以排除万难,拥有无限的金钱和人力,在伦理审批上也很难通过——用常识就可以想出,这样的双盲实验既不现实,也不人道。
所以,在衰老干预领域,干预物质的研究通常都会停留在临床前的动物实验阶段,后续的临床实验通常会以安全性实验和对具体病症的疗效试验为主[18]。
这背后还隐藏着另一个重大问题:我们是否应当将衰老视为一种疾病?
大卫·辛克莱尔几乎在所有演讲、采访中都会提到一个观点:“衰老是一种疾病,而且是一种可以治疗的疾病”。 《华尔街日报》称这是一种“诱人的想法”(seductive notion),当然也有批评人士认为这是一种危险的想法。
简而言之,如果我们认为“衰老是疾病“,那是否就应该把所有老年人视为不健全的人?假如“老人”就是“病人”,势必会加剧社会对老年人的歧视,并且完全否定了人在老年期间还能取得成就或者获得幸福。
当然,视衰老为疾病也有对应的好处。这意味着老年人可以更重视“衰老”本身,不再将自己身体机能的下降单纯归结为“老了”。同时,社会资源、医疗资源也可以在政策、市场层面上对衰老干预策略进行支持与帮助。
世界卫生组织曾经在ICD-10中把“衰老”定义为疾病,但随后在ICD-11中又降级。我国尚未正式批准任何药物用于衰老干预,但仍在高度关注老年健康。政府发布的《健康中国行动(2019—2030年)》文件把“延长健康寿命”作为基本路径之一列出。
科学研究当然需要最严格的规则和审视,但衰老往往不等人。
全球巨头都在躬身入局衰老干预产业
衰老不等人这件事在顶级富豪和科学家身上都体现的淋漓尽致。
或者说,因为衰老干预领域和商业高度契合,很多布局从科研阶段就已经开始布下。上文提到的哈佛大学教授大卫·辛克莱尔,在哈佛大学公开的资料中,可以看到他创立或参与了数十家公司,有面向消费者的Elysium,也有针对特定技术的Senolytic Therapeutics等等。
像是《纽约时报》《华尔街日报》等媒体也都多次报道他的“商业帝国”,尽管内容角度不一,但这完全可以证明,衰老行业是一个高度商业化的领域。除辛克莱尔外,柯克兰所在的梅奥诊所也公开投资了多家生物科技公司,完成了在行业中的布局。

除了科研院所和医院外,全球最富有的那些公司和个人也都在衰老干预领域有多年投入。像是谷歌投资的Calico、亚马逊创始人杰夫·贝佐斯(Jeff Bezos)投资的Altos Lab、OpenAI创始人山姆·奥尔特曼(Sam Altman)投资的Retro Bioscience,近年来都吸引了大量顶尖科学家,并开始产出科研和转化成果。
不光是海外市场,目前国内也有不少机构正在衰老干预领域进行布局,这其中不乏国有资本。据新华网,国药集团2023年就与美国原研药企赛诺根(Seragon)成立了合资公司国药赛诺根,并加速推进了由哈佛、梅奥参与技术输出的SRN-901衰老干预技术的商业化进程。
无论你如何看这种结合,这一切都正在快速发生。
我们为什么需要长寿?
我们当然希望活久一点,但我们更希望拥有一个健康的晚年。白岩松在两会中提到的“健康寿命” 衡量的就是一个人在保持健康和活力的状态下,能够度过的年数,而非单纯的生存年数。

延长寿命和提升健康寿命的社会意义也十分重大。一项美国研究利用微观仿真模型比较了不同情景:延长健康寿命(延缓衰老)与单独攻克某些重大疾病的效果。结果发现,延缓衰老可使人均寿命额外延长2.2年,而且新增寿命的大部分都处于健康状态。这不仅带来巨大的健康收益(研究估算其经济价值约为未来50年累计7.1万亿美元),也意味着老年慢性病和失能总体负担的下降[19]。
同样,中国社会科学院财经战略研究院的一项研究也指出,提高健康预期寿命,缩小健康预期寿命与平均预期寿命之间的差距,有助于促进高质量人力资本积累,推动技术进步和技术创新,实现经济高质量发展[20]。
总而言之,这件事无论对于个体本身,还是对于国家和社会的整体战略,都有着非比寻常的重要意义。

基于上述背景,我们也大可不必担心“长寿药”成为少数富人的私有物品。一切技术在推出之后,都会随着市场和研发的进展,逐渐变得便宜与普及。1899年,当拜耳公司刚刚推出阿司匹林时,每片价格都相当于如今的几十元人民币那么高,现在随着技术发展与政策调整,我们每个人都可以享受几分钱一片的“神药”了。
衰老干预技术也是一样。在技术与研究刚刚转化的阶段,价格可能相对较高,但随着技术发展与进步,最终所有人都会享受到技术带来的好处。
让长寿触手可及,绝对不是一句口号。
参考资料:
[1] Olshansky, S. J., Willcox, B. J., et al. Implausibility of radical life extension in humans in the twenty-first century. Nat Aging. 2024 Nov;4(11):1635-1642.
[2] López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G. Hallmarks of aging: An expanding universe. Cell. 2023;186(2):243-278.
[3] Di Francesco A, Deighan AG, Litichevskiy L, et al. Dietary restriction impacts health and lifespan of genetically diverse mice. Nature. 2024;634(8034):684-692.
[4] Colman RJ, Anderson RM, Johnson SC, et al. Caloric restriction delays disease onset and mortality in rhesus monkeys. Science. 2009;325(5937):201-204.
[5] Zhao D, Guallar E, Woolf TB, et al. Association of eating and sleeping intervals with weight change over time: The Daily24 cohort. Journal of the American Heart Association. 2023;12(3).
[6] Papadopoli D, Boulay K, Kazak L, et al. mTOR as a central regulator of lifespan and aging. F1000Research. 2019;8:998.
[7] Mannick JB, Lamming DW. Targeting the biology of aging with mTOR inhibitors. Nature Aging. 2023;3(6):642-660.
[8] Yang Y, Lu X, Liu N, et al. Metformin decelerates aging clock in male monkeys. Cell. 2024;187(22):6358-6378.e29.
[9] Gomes AP, Price NL, Ling AJY, et al. Declining NAD+ Induces a Pseudohypoxic State Disrupting Nuclear-Mitochondrial Communication during Aging. Cell. 2013;155(7):1624-1638.
[10] Kane AE, Chellappa K, Schultz MB, et al. Long-term NMN treatment increases lifespan and healthspan in mice in a sex dependent manner. bioRxiv (Cold Spring Harbor Laboratory). June 2024.
[11] Poljsak B. NAMPT-Mediated NAD Biosynthesis as the internal timing mechanism: In NAD+ world, time is running in its own way. Rejuvenation Research. 2017;21(3):210-224.
[12] Alegre GFS, Pastore GM. NAD+ precursors nicotinamide mononucleotide (NMN) and nicotinamide riboside (NR): Potential dietary contribution to health. Current Nutrition Reports. 2023;12(3):445-464.
[13] Bi S, Jiang X, Ji Q, et al. The sirtuin-associated human senescence program converges on the activation of placenta-specific gene PAPPA. Developmental Cell. 2024;59(8):991-1009.e12.
[14] Pearson KJ, Baur JA, Lewis KN, et al. Resveratrol Delays Age-Related Deterioration and Mimics Transcriptional Aspects of Dietary Restriction without Extending Life Span. Cell Metabolism. 2008;8(2):157-168.
[15] Palmer AK, Kirkland JL. Aging and adipose tissue: potential interventions for diabetes and regenerative medicine. Experimental Gerontology. 2016;86:97-105.
[16] Xu M, Pirtskhalava T, Farr JN, et al. Senolytics improve physical function and increase lifespan in old age. Nature Medicine. 2018;24(8):1246-1256.
[17] Tessier AJ, Wang F, Korat AA, et al. Optimal dietary patterns for healthy aging. Nature. March 2025.
[18] Harinath G, Lee V, Nyquist A, et al. Safety and efficacy of rapamycin on healthspan metrics after one year: PEARL Trial Results. medRxiv (Cold Spring Harbor Laboratory). August 2024.
[19] Goldman DP, Cutler D, Rowe JW, et al. Substantial health and economic returns from delayed aging may warrant a new focus for medical research. Health Affairs. 2013;32(10):1698-1705.
[20] 张颖熙,夏杰长. 健康预期寿命提高如何促进经济增长? ———基于跨国宏观数据的实证研究. 管理世界. 2020, 36(10): 41-53+214-215.
