在神经科学领域,脑炎症被认为是许多神经退行性疾病和急性脑损伤的核心病理机制。尤其是在中风、创伤性脑损伤(TBI)和阿尔茨海默病等疾病中,过度的炎症反应不仅无法有效修复损伤,反而会进一步破坏神经组织,加速功能丧失。近年来,科研人员开始关注NAD+(烟酰胺腺嘌呤二核苷酸)在神经炎症中的作用,NAD+不仅是细胞能量代谢的重要分子,还在免疫调节、抗氧化和DNA修复等多方面发挥着关键作用。
近期,斯坦福大学医学院发表在《神经炎症杂志》的一项研究,为NAD+在中风后神经炎症中的作用提供了直接证据。研究指出,NAD+水平的下降与中风后免疫失调、神经炎症加剧及衰老进程显著相关[1]。同时科学家发现:通过补充NAD+前体物质烟酰胺核糖(NR),可以成功逆转这一病理过程,为老年中风的预防性干预开辟了新路径。

NAD+:细胞能量与免疫调节的核心分子
NAD+是细胞内不可或缺的辅酶,深度参与细胞的能量代谢、氧化还原反应、DNA修复及免疫调控等基本生命过程。它是线粒体内呼吸链的核心组成部分,直接驱动细胞能量来源ATP的合成。同时,NAD+通过激活Sirtuins(去乙酰化酶)蛋白家族,调控包括细胞衰老、基因表达和损伤修复在内的多种生理活动。
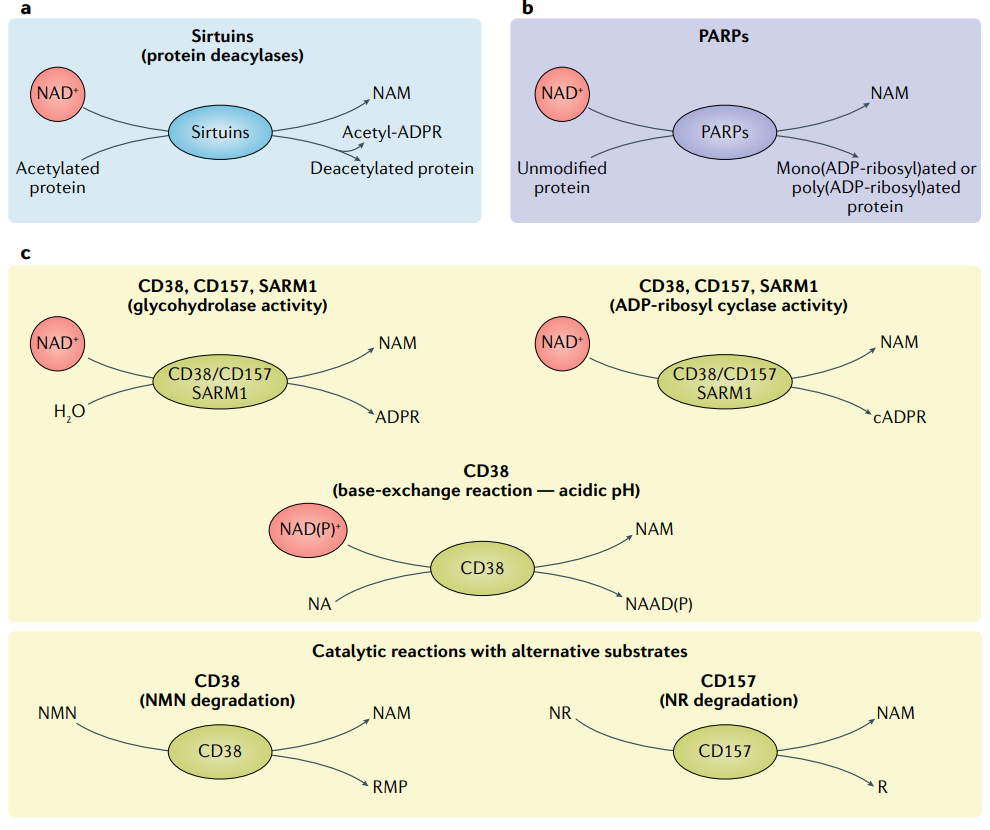
随着年龄增长,体内NAD+水平自然下降,这直接导致细胞代谢效率降低、氧化应激增加和修复能力减弱,进而引发慢性炎症状态,这一现象常被称为“炎性衰老”。NAD+的缺乏会削弱免疫细胞的代谢适应能力,使其在应对中风、感染或创伤时容易反应过度,从而加剧神经损伤。
以急性缺血性中风为例,损伤发生后,大量免疫细胞浸润脑组织,释放炎症因子,本意在于清除坏死细胞。然而,若炎症反应失控或持续过久,便会引发“二次损伤”,导致健康的神经元死亡,梗死范围扩大。
NAD+与中风:年龄是关键影响因素
这项研究采用了缺血性中风小鼠模型,科学家系统比较了年轻(3-6月龄)和老年(18-20月龄)小鼠在中风后外周血单核细胞的代谢轨迹与炎症表型演变,揭示了显著的年龄依赖性差异。
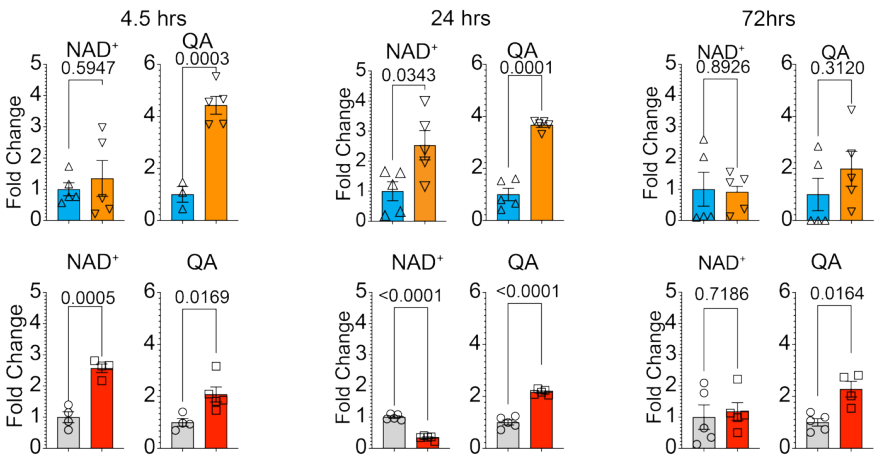
NAD+水平的年龄差异
老年小鼠在中风后24小时,其循环单核细胞内的NAD+水平显著降低,同时伴随神经毒性代谢物——喹啉酸(QA)的异常积累。QA本是NAD+合成通路(Kynurenine途径)中的中间产物,正常情况下应进一步转化为NAD+前体NaMN。
代谢轨迹的年龄差异
年轻小鼠在中风后表现出良好的代谢适应:单核细胞在损伤早期(4.5小时)保持稳定的代谢状态,24小时内经历短暂的功能耗竭后,于72小时左右恢复常态。相反,老年小鼠的代谢轨迹截然不同:早期即出现过度激活(氧化磷酸化与糖酵解双双攀升),随后迅速陷入持久的功能衰竭状态,且与NAD+的急剧下降同步。
Kynurenine通路(犬尿酸通路)的失调
NAD+可通过多种途径合成,其中Kynurenine通路(KP)在在免疫应激时是NAD+的重要来源。研究发现,中风后该通路在年轻和老年小鼠的单核细胞中均被激活,但在老年个体中,QA向NaMN的转化效率显著受损,造成QA堆积。QA具有神经毒性,可通过过度激活NMDA受体诱发神经元兴奋性损伤,并进一步破坏线粒体功能,形成“炎症-代谢”恶性循环。
NR干预:多系统协同保护重塑代谢
针对老年单核细胞的代谢缺陷,研究团队采用为期4周的NR口服预处理(400 mg/kg/天),而非急性给药。结果显示,NR在多个层面实现了系统性保护:
免疫细胞代谢功能复苏
在老年中风小鼠中,NR处理显著提高了单核细胞的NAD+水平,增强了基础呼吸、ATP产生和糖酵解活性。这逆转了老年单核细胞的代谢耗竭状态,使其代谢特征向年轻化转变。
系统性炎症风暴平息
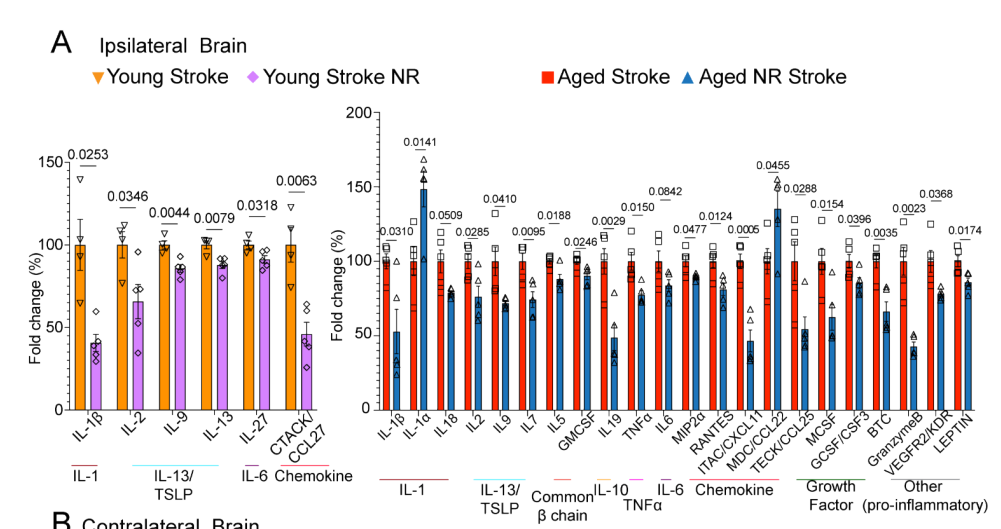
NR处理显著降低了老年小鼠单核细胞中多种促炎因子的表达,包括与单核细胞增殖、分化和迁移相关的MCP3/CCL7等。同时,血浆中的系统性炎症标志物也显著减少。
修复肠道屏障完整性
该研究最具创新性的发现是揭示了NAD⁺-肠道-脑轴的调控网络。卒中后交感神经爆发性激活导致肠道上皮紧密连接破坏,细菌内毒素LPS入血,形成"肠漏-内毒素血症-全身炎症-脑炎加剧"的恶性循环。老年小鼠肠道通透性增加3倍以上,固有层巨噬细胞数量锐减且功能耗竭。NR的处理在肠道形态、免疫和代谢层面显著逆转了这一病理过程。
改善神经功能结局
在功能层面,NR处理显著改善了老年中风小鼠的运动协调能力,减少了脑梗死面积。这一效果可能源于多系统的协同作用:通过改善外周免疫细胞代谢、减轻系统性炎症、保护肠道屏障,最终降低神经炎症负担。
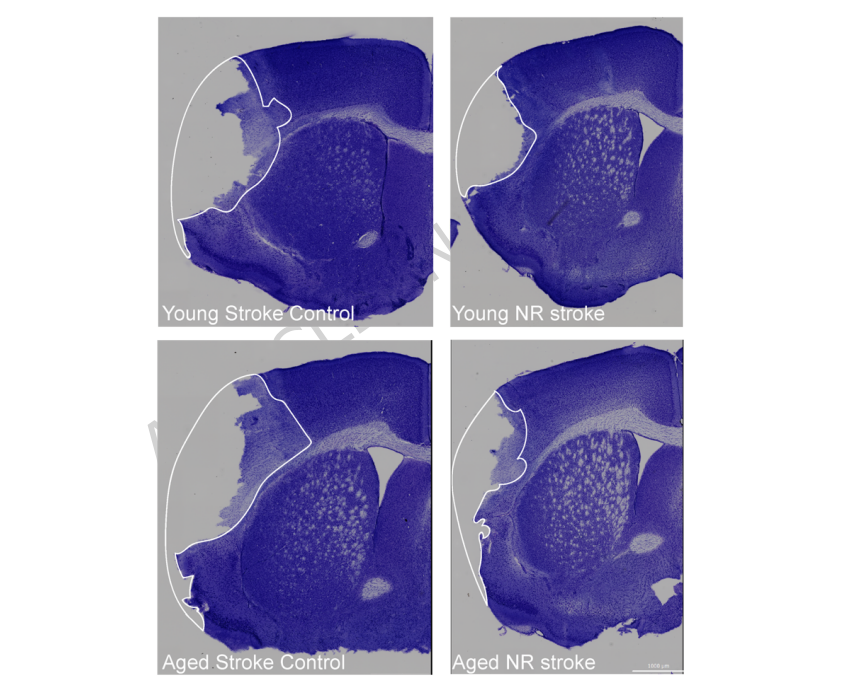
NAD+在大脑炎症调节中的潜力
NAD+补充,尤其是通过NR等前体物质的补充,在调控神经炎症、维护脑健康方面展现出巨大潜力。现有研究表明,NR在衰老、神经退行性疾病及中风后都能发挥显著的神经保护作用[2,3]。
因此,NAD+的补充被认为是未来治疗神经炎症、预防和治疗中风等疾病的一个重要方向之一。
尽管NAD+补充具有潜力,但需注意,NAD+水平的补充需要长期和持续的干预,短期的补充可能效果有限。关于NAD+前体NMN/NR的更多益处和临床研究,请见《长寿指南》。
这项开创性研究将年龄相关的中风后神经炎症与NAD+代谢紧密联系起来,阐明NAD+耗竭是驱动老年个体过度炎症反应的关键环节。通过补充NR提升NAD+水平,不仅能改善免疫细胞的代谢功能与炎症表型,还可增强肠道屏障防御,形成从外周至中枢的协同保护网络。
在人口老龄化加剧、脑血管疾病负担日益加重的当下,这项研究为开发针对年龄相关神经炎症的精准干预措施奠定了科学基础。NAD⁺补充代表了从"对抗疾病"到"维持健康"的范式转移——通过维持细胞能量代谢平衡,特别是NAD⁺稳态,促进健康老龄化,减轻神经炎症负担。
随着代谢科学与神经免疫学不断交叉融合,维持NAD+稳态或将成为促进健康老龄化、减轻神经炎症负担的关键策略之一,引领我们步入一个通过代谢干预调节脑健康的新时代。
参考资料:
[1] Cabrera, M. et al. NAD+ depletion drives age-related monocyte hyperinflammation after stroke and is reversed by nicotinamide riboside. Journal of Neuroinflammation (2025) doi:10.1186/s12974-025-03638-6.
[2] Orr, M. E. et al. A randomized placebo-controlled trial of nicotinamide riboside in older adults with mild cognitive impairment. GeroScience 46, 665–682 (2023).
[3] Vreones, M. et al. Oral nicotinamide riboside raises NAD+ and lowers biomarkers of neurodegenerative pathology in plasma extracellular vesicles enriched for neuronal origin. Aging Cell 22, (2022).
[4] Covarrubias, A. J., Perrone, R., Grozio, A. & Verdin, E. NAD+ metabolism and its roles in cellular processes during ageing. Nature Reviews Molecular Cell Biology 22, 119–141 (2020).
