如果器官有“替换装”,我们能活得更久吗?
对于这个问题,理论上当然是能!要知道,我们器官的衰老和身体的衰老并不是完全同步的,尤其是在疾病的影响下,器官的衰老往往会加速全身的衰退。
如果我们身体的每个器官都有替换装,我们似乎就不会那么害怕疾病与衰老。我知道,你一定觉得这个想法很疯狂,但事实是,已经有人在这样做了。
美国富豪布莱恩·约翰逊(Bryan Johnson)就曾换了17岁儿子的血液实现逆龄。虽然替换器官要比换血复杂得多,不仅要模拟器官的形态,还要兼具同样的功能,但这并非不可能。

但是,器官供体资源是极度短缺的,世界上每天有成千上万的人在等待器官移植,不少人甚至等不到合适的供体。如果有一条成熟的“器官替换装”生产线,就像蜥蜴人一样,给自己打一针,断臂就能重生,那么不仅能够拯救许多等待移植的患者,还能推动人类长寿迈向一个新的里程碑。
但我们从哪里获得足够的“替换装”?目前学术界和工业界已经有了一些初步的探索。
猪心与钛合金心脏,能跳多久?
异种移植和人工器官是近年来缓解供体不足的主要方案。
异种移植是将动物的(目前主要是猪)器官基因改造后,移植到人体内。之所以选择猪作为供体,是因为猪的器官大小与人类相似,且传染病的风险较低,基因背景清晰,便于改造。
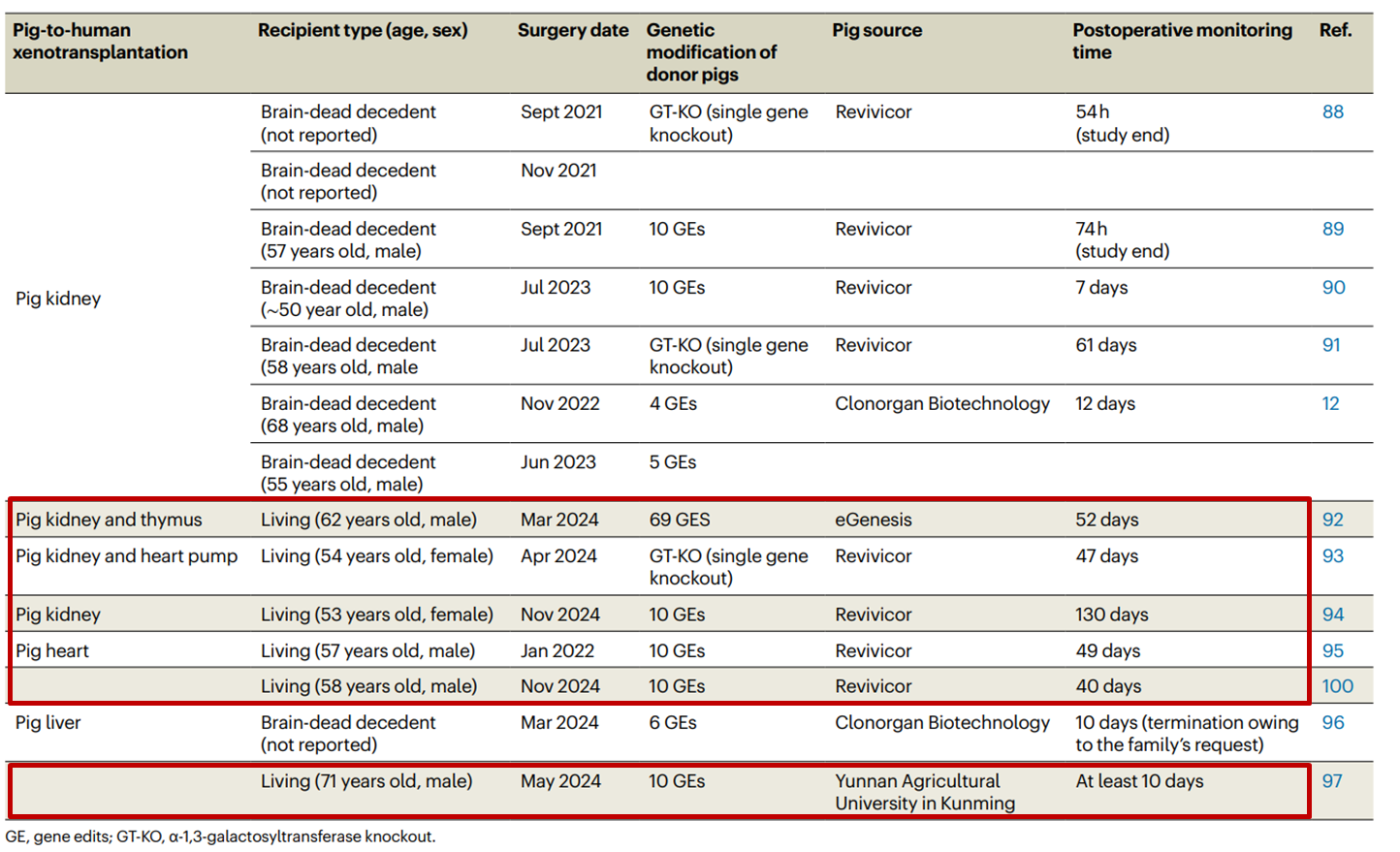
目前,全球共完成了6例活体异种移植临床试验[9],已成功将猪心脏、猪肾脏、猪肝脏替换到人体当中。其中世界首例基因编辑猪肝脏活体移植,于去年5月由我国科学家完成。
然而异种移植也并非万能解药。6位患者中,有4位因疾病发展,或者排斥反应等在术后两个月内去世。一名猪肾脏移植患者由于排斥反应,猪肾在130天后被移除,这也是迄今为止异种器官在人体内最久的纪录。
相比之下,人工器官似乎更加成熟。像我们熟知的血液透析就是一种人工肾脏,而人工心脏的种类更多,技术也更加先进。
去年,美国FDA批准了BiVACOR公司金属钛心脏的临床试验,钛心脏在患者胸腔中最长跳动了105天。而我国自主研发的磁悬浮人工心脏,也在不断进行技术突破,重量从90克减轻到45克,是全球最小的人工心脏,并已成功应用到终末端心脏衰竭患者中。

但是,这类人工心脏的使用时间一般在3个月到几年不等,价格昂贵,一颗磁悬浮心脏的价格大概在70-80万人民币左右,这让许多患者依旧选择等待心脏供体移植,而能否等到合适的供体还取决于患者的个体差异、病情状况等等。
总而言之,无论异种移植的“猪心”,还是人工器官“钛合金心”,都不如我们的“本心”。最理想的当然还是用我们人类的“同种器官”进行移植。
从“类器官organoids”到“类人体bodyoids”,还会很远吗?
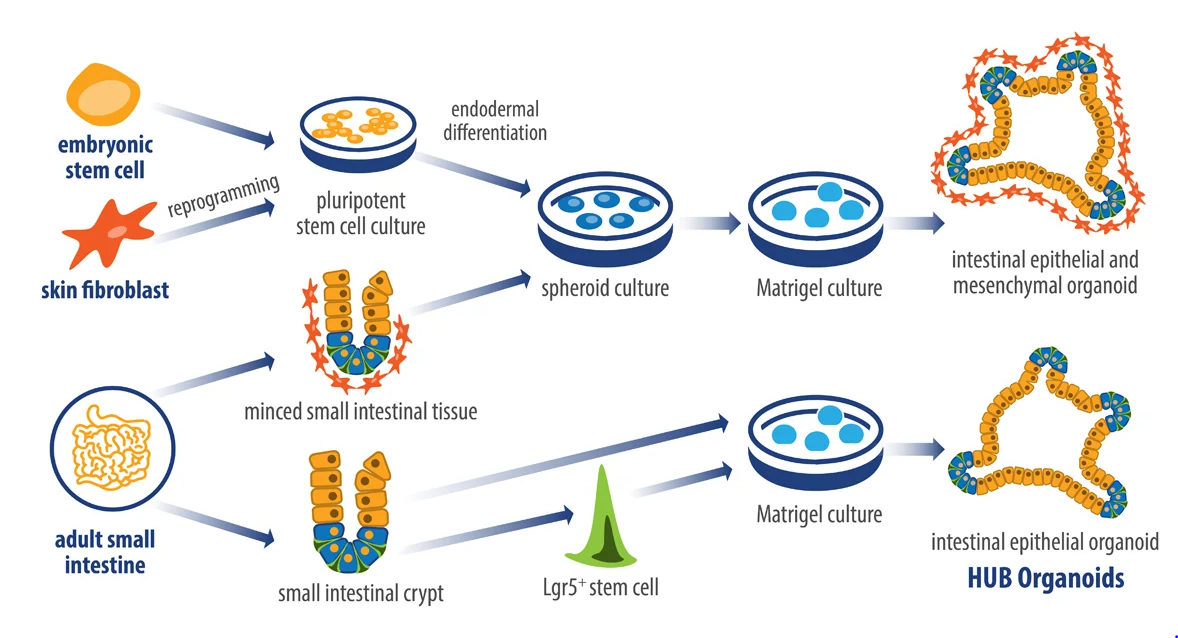
近年来,类器官(organoids)已成为再生医学领域的热门研究方向,本质就是用人的细胞作为种子,在体外培养基里“种”出器官。
其实种出来也不是真正的器官,而是可以模拟器官结构和功能的“培养物”。举个例子,在培养基中种下胰岛细胞,长出来的不是整个胰岛,而是具有部分胰岛功能的“细胞团”。
那么类器官有什么用呢?我们先思考一个问题:为什么一款药物的研发周期这么长?这么困难?
暂且不算靶点发现和验证的早期阶段,直接从拿到候选分子开始,就先要在动物体内(通常是小鼠)进行药效和毒性初筛,临床前安全性、有效性评价。如果哪一步出了问题,候选分子就要继续优化,直到把这些步骤都顺利通关。
接下来就是临床试验,这个过程需要招募志愿者在人体内做3-4期临床试验,因为对小鼠管用不等于对人体管用,对小鼠无毒不代表对人体无毒。各大药企在前期投入很多,小鼠实验中进展顺利,最终折在3-4期临床试验的候选物比比皆是。
那么,如果能直接用人体做试验,是不是能加快筛选速度?当然这不合伦理,也不合法。
这个时候“类器官”出现了,首先类器官的“种子”来源于人体,它比单纯的人体细胞和小鼠模型更接近于人体真实情况,用来筛选药物,可以提高候选药物的命中率,提高研发效率,节约研发成本。
而近期,MIT Technology review上的一篇报道,提出了一个更疯狂的想法,就是创造“类人体bodyoids”,单纯一个器官还不足以代表人体的复杂,创造一个生物学意义上的人体——代替人类进行实验,会不会更有效率?
类人体如何应用于器官再生领域?或将面临伦理挑战
“类人体bodyoids” 的概念一经提出,率先引发了科学界和伦理界的广泛讨论。
类人体 (bodyoids )是指通过生物技术,如诱导多能干细胞(iPSCs)和人工子宫技术,在体外培育出的具有部分或完整人体结构和功能的实体。它们拥有各种器官和组织,但没有大脑皮层,因此没有意识、没有疼痛、没有自我。
患者可以用自己的细胞产生器官,本质上就是“克隆”自己的“零件”,这不仅解决了供体资源短缺的问题,还实现了完美配型,消除了免疫抑制。
若真如此,以后新药研发也方便多了,招募志愿者取他们的细胞,做出一些“类人体”,直接上临床前试验,取代“小白鼠”。
听起来简直不要太爽。
但是,从伦理上讲,没有意识的“类人体”到底算不算人类?是不是生命?它的出现能否被社会所接受?
其实,我们不去挑战伦理,也可以慢慢达成这个成就,只是会比较漫长。
兔子耳朵的启示:再生不是神话,只是被“关掉”
今年6月,中国学者王伟在《科学》发表了重磅论文,他们发现,兔子耳朵被打孔后能在30天内完全再生,而小鼠却只能留下一个永远无法愈合的洞[1]。
他们通过单细胞测序发现,兔子的伤口附近会聚集一种成纤维细胞(WIFs),这种细胞在受伤后迅速启动一个名为Aldh1a2的基因,合成视黄酸(RA),告诉细胞该如何重建组织。
而在小鼠体内,Aldh1a2 基因几乎不表达。不是因为它坏了,而是它“被关掉了”——研究者发现,与兔子相比,小鼠耳朵部位缺少了启动Aldh1a2 基因的增强子,导致受伤时Aldh1a2 基因无法表达。
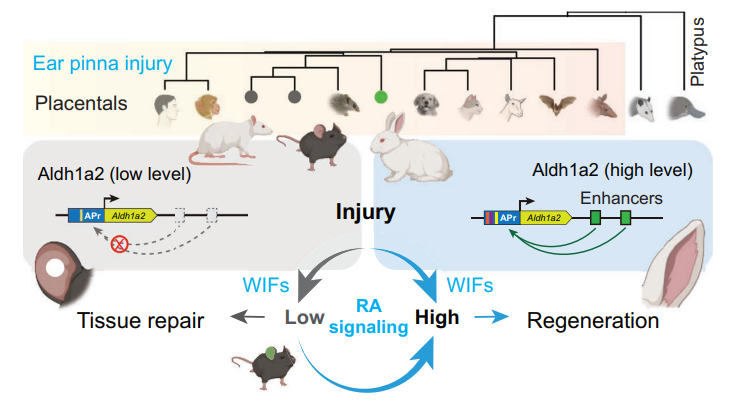
当科学家把兔子耳朵的Aldh1a2增强子移植到小鼠基因组中,小鼠耳朵也开始再生,还长出了完整的软骨、神经和皮肤。
也就是说,小鼠不是不能再生,而是“忘了怎么再生”。那么人类是否也是一样,忘记了如何再生呢?
再生医学如何应用到衰老干预领域?
再生医学正在改变我们对疾病与衰老的认知。从干细胞疗法到基因编辑,科学家们正逐步攻克组织修复与再生的难题。
先说说干细胞疗法
衰老会导致干细胞数量和活性会降低,而干细胞是组织细胞再生的关键。将分化的细胞移植到炎症或损伤部位,就会产生各种化学因子来促进受损组织修复,这个方法已被证明可以治疗许多衰老相关疾病。
2008年的一项研究用骨髓来源的小鼠间充质干细胞移植,成功挽救了小鼠的肝衰竭,促进肝脏再生,为治疗肝脏疾病提供器官移植的潜在替代疗法[2]。
2016年,一项多中心、随机、双盲、安慰剂对照的三期临床试验对212名克罗恩病患者进行了脂肪干细胞治疗,随后这一方法通过了临床安全性和有效性评价,成为了全球首个获批的干细胞药物Alofisel(Cx601)[3]。

再说说基因治疗
基因治疗是指通过CRISPR/Cas9 技术,将基因片段导入细胞中进行疾病干预的治疗方法,能缓解甚至逆转个体衰老表征,使组织或器官 “年轻化”。
美国索尔克研究所的科研人员通过间歇性诱导山中因子Oct4、Sox2、c-Myc、Klf4的表达,诱导细胞重编程,发现能逆转早衰症小鼠的衰老表征,并使小鼠寿命延长了30% [4,5]。
基因编辑技术与干细胞疗法结合
基因编辑技术结合干细胞疗法的优势在于:用于基因治疗的改造后干细胞来源于患者自身,能够避免自身免疫、安全性更高。
刘光慧团队2016年发现了抗氧化转录因子NRF2对于早衰综合征的间充质干细胞衰老很重要,随后他们用基因编辑技术,把人类胚胎干细胞中 NRF2 基因第 2 号外显子里的一个核苷酸(A245G)换了,获得了活性更强的间充质干细胞。经过改造后的增强型干细胞在移植治疗小鼠后肢缺血时,有效性及安全性都更优秀[6,7]。
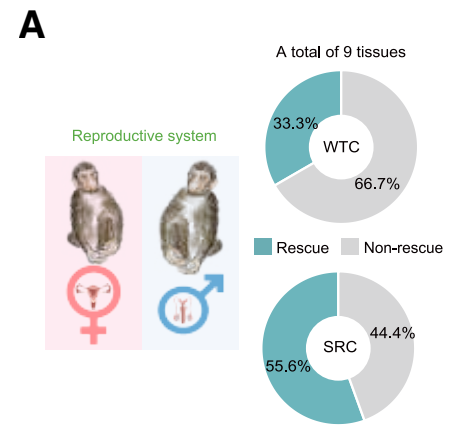
而最近,刘光慧团队又在《细胞》上发表了团队开发的一种抗衰老的基因工程人类间充质祖细胞(SRCs),能够通过增强长寿基因FOXO3活性使其抵抗衰老。将改造后的SRCs注射至老年猕猴体内,44周后,猕猴的衰老标志物显著减少,认知功能、骨密度和生殖健康都得到了改善[8]。
人类对长寿的追求从未停止,从异种移植到人工器官、从类器官培养到基因编辑和干细胞疗法的结合,再生医学正一步步改写生命的可能。
虽然完全实现“器官替换装”仍面临许多挑战,但每一次技术进步都让我们看到,人类延长健康寿命的梦想正变得越来越触手可及。
参考资料:
[1]Lin, W. et al. Reactivation of mammalian regeneration by turning on an evolutionarily disabled genetic switch. Science 388, (2025).
[2]Kuo, T. K. et al. Stem cell therapy for liver disease: Parameters governing the success of using bone marrow mesenchymal stem cells. Gastroenterology 134, 2111-2121.e3 (2008).
[3]Panés, J. et al. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn’s disease: a phase 3 randomised, double-blind controlled trial. The Lancet 388, 1281–1290 (2016).
[4]Ocampo, A. et al. In vivo amelioration of Age-Associated hallmarks by partial reprogramming. Cell 167, 1719-1733.e12 (2016).
[5]Browder, K. C. et al. In vivo partial reprogramming alters age-associated molecular changes during physiological aging in mice. Nature Aging 2, 243–253 (2022).
[6]Kubben, N. et al. Repression of the antioxidant NRF2 pathway in premature aging. Cell 165, 1361–1374 (2016).
[7]Yang, J. et al. Genetic enhancement in cultured human adult stem cells conferred by a single nucleotide recoding. Cell Research 27, 1178–1181 (2017).
[8]Lei, J. et al. Senescence-resistant human mesenchymal progenitor cells counter aging in primates. Cell (2025) doi:10.1016/j.cell.2025.05.021.
[9]Loupy, A. et al. Reshaping transplantation with AI, emerging technologies and xenotransplantation. Nature Medicine (2025) doi:10.1038/s41591-025-03801-9.
