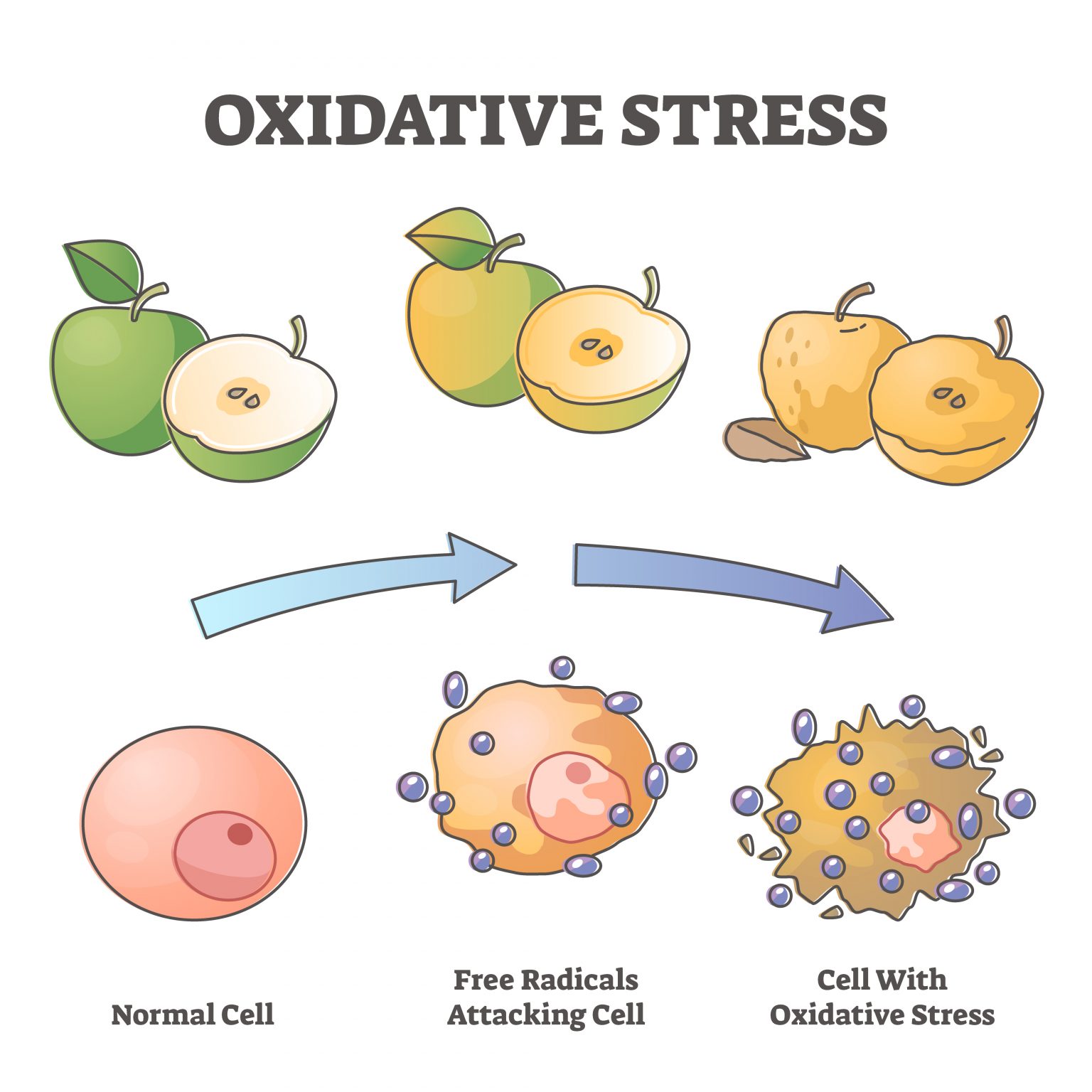
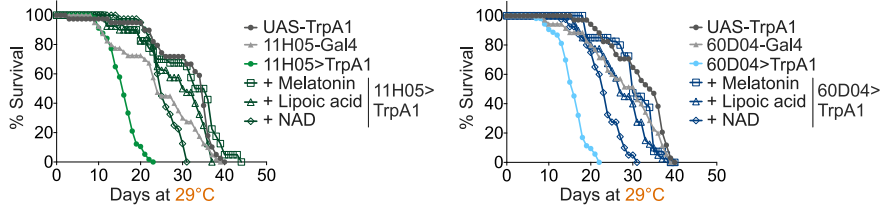
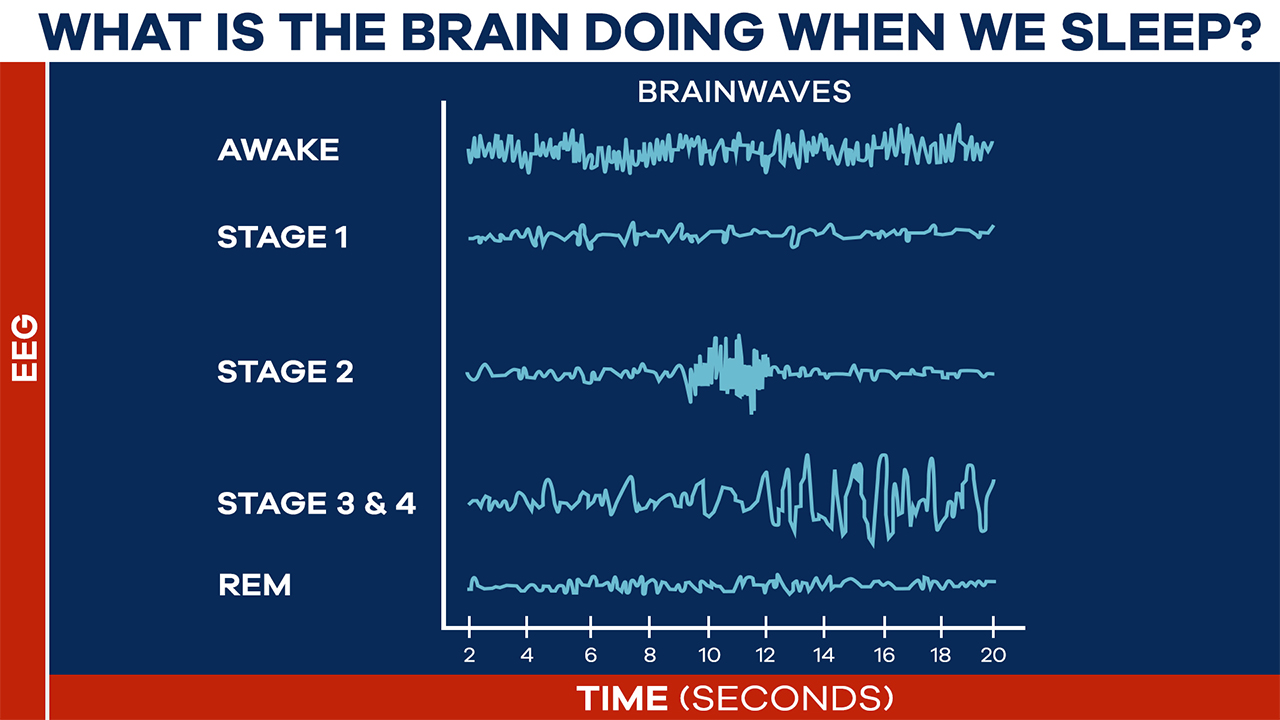
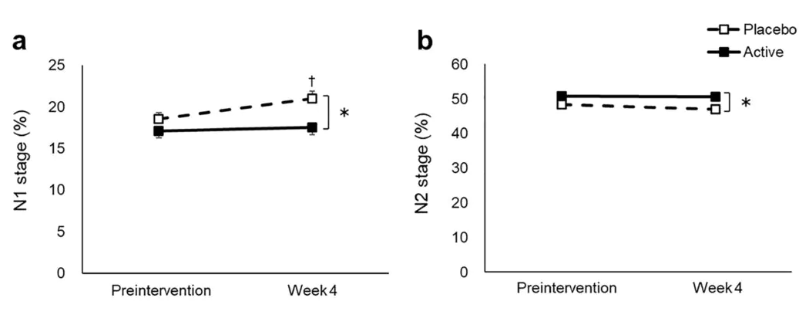
充足的睡眠是健康老龄化的基础。全球大约有三分之一的人存在睡眠不足的问题,但其中很多人还没有意识到睡眠差带来的一系列健康后果。 像情绪烦躁、注意力难以集中等等只是睡眠不足最明显的“阳性”表现,在你的细胞中还正在发生你看不见的“阴性”表现——氧化应激就是最主要的“阴性”表现。 要真正搞清楚睡眠不足的影响,必须了解活性氧(ROS)是什么。ROS是正常代谢的副产物,富集到较高浓度就会变得有害。 过量的 ROS 通常会被抗氧化剂中和,但它们的过量产生会压倒我们的抗氧化防御系统。这种不平衡会导致氧化应激,这一过程会损害 DNA、蛋白质和脂质等重要的细胞成分[1]。 2020年,哈佛医学院神经生物学教授德拉加纳·罗古利亚(Dragana Rogulja)和她的团队在《Cell》上发表研究发现,睡眠不足会导致肠道氧化应激,从而缩短果蝇和小鼠的寿命[2]。 而肠道微生物组对调节整个身体的健康和寿命很重要,特别容易受到氧化应激的影响[3]。此外,氧化应激是细胞衰老的关键驱动因素,几乎与所有年龄相关的疾病有关,包括心血管疾病、神经退行性疾病和癌症等。在人类中,氧化应激与较高的过早死亡风险有关[6]。 重要的是,哈佛大学的科学家们还证明,如果阻止氧化应激,即使在持续睡眠不足的情况下,果蝇也可以拥有正常的寿命。这更加凸显了减轻氧化应激作为保持健康和长寿策略的重要性。 不久前德国莱布尼茨研究所的科学家在bioRxiv发表预印本研究中指出,在小鼠中,睡眠不足会导致线粒体功能障碍,驱动衰老加速[4]。 线粒体是细胞能量的主要生产者,负责产生大部分的细胞能量(ATP)。但线粒体也需要休息,在我们的睡眠期间,线粒体活动会降低,以实现自身修复。在睡觉时,线粒体往往会融合,形成更大的线粒体,这是维持细胞健康至关重要的过程[7]。 但睡眠不足会破坏这一恢复过程,导致各种线粒体功能障碍,包括 ATP 合成受损和 ROS 产生增加,从而形成恶性循环,受损的线粒体产生更多有害分子。 因此,保持最佳的线粒体功能对于细胞寿命和整体健康至关重要。当线粒体健康高效时,细胞可以有效地自我修复,维持正常功能,抵抗衰老的破坏。 沿着这一思路,我们可以简单粗暴的认为,抵抗氧化应激就是在改善睡眠。一些临床试验已经印证了这一结论。 例如,由日本三得利全球创新中心公司进行的一项研究,验证了最近很火的抗氧化成分麦角硫因,对于改善睡眠困难和睡眠相关指标的能力[5]。 该研究共纳入了92名平均年龄约53岁的参与者,他们都存在与压力和焦虑相关的轻度睡眠问题。在为期四周的试验中,一组参与者每天服用20毫克的麦角硫因补充剂,另一组服用安慰剂。 为了客观地评估睡眠,研究人员让参与者连续三天佩戴脑电图(EEG)设备入睡。EEG是一种带有电极的帽子,可测量脑波活动。我们处于清醒或不同睡眠阶段时,脑波会发生变化。因此,EEG可帮助研究人员测量参与者的睡眠阶段。 结果发现,麦角硫因显著改善了参与者的睡眠质量,减少了浅睡阶段的时间,并延长了对记忆巩固至关重要的第二阶段睡眠(N2阶段)的持续时间。此外,服用麦角硫因的参与者入睡后醒来的次数也明显减少,表明睡眠的深度和连贯性有所改善。 这些结果表明,通过调节活性氧的水平,尤其是采用具有抗氧化作用的成分,如麦角硫因,能够有效改善睡眠质量,减轻睡眠不足对身体健康的负面影响。 除了麦角硫因之外,长寿之家Changshou.com还介绍过许多其他抗氧化成分也被证明对改善睡眠具有积极作用。例如,茶氨酸、NMN(烟酰胺单核苷酸)、NR(烟酰胺核苷、藏红花素、PQQ(吡咯喹啉醌)等成分,都在不同的研究中表现出了改善睡眠的潜力。 2020年,哈佛大学的研究团队通过实验发现,来自53种食物的补充剂对果蝇的睡眠剥夺后寿命产生了积极影响。这些补充剂中的一些成分,如褪黑素、硫辛酸、NAD+等,都被证实能够延长果蝇的寿命并改善其睡眠质量[2]。 除了营养补充剂,日常生活中的一些健康习惯也可以帮助减少氧化应激的负面影响。适当的运动、健康的饮食、保持良好的心理状态等,都是调控ROS水平、减少氧化应激的有效手段。 因此,睡眠不足的后果不容忽视,它对健康的潜在威胁已远超我们的认知范围。现代社会的快节奏生活往往让人忽略了充足的睡眠,而这也成了许多慢性疾病的“温床”。 随着对活性氧(ROS)在健康中的作用研究的深入,我们应认识到,阻断“氧化应激-线粒体功能障碍-细胞衰老-寿命缩短”的级联损害,逐渐成为未来改善睡眠质量、延缓衰老和促进健康的有效干预路径。 在这一背景下,国药赛诺根推出的最新睡眠黑科技产品恩利维®(Enlivien®),正是针对这一路径为我们提供有效的睡眠修复解决方案。 健康的睡眠,是我们追求长寿与活力的第一步。睡眠不足与氧化应激
良好的睡眠益于保持线粒体健康
调控活性氧(ROS)或成为改善睡眠新路径
如何抗氧化应激
睡眠不足的后果应该引起广泛的重视

[1]Liguori, I., Russo, G., Curcio, F., Bulli, G., Aran, L., Della-Morte, D., Gargiulo, G., Testa, G., Cacciatore, F., Bonaduce, D., & Abete, P. (2018). Oxidative stress, aging, and diseases. Clinical interventions in aging, 13, 757–772. https://doi.org/10.2147/CIA.S158513 [2]Vaccaro, A. et al. Sleep Loss Can Cause Death through Accumulation of Reactive Oxygen Species in the Gut. Cell 181, 1307-1328.e15 (2020). [3]Ghosh, T. S., Shanahan, F., & W., P. (2022). The gut microbiome as a modulator of healthy ageing. Nature Reviews Gastroenterology & Hepatology, 19(9), 565-584. [4]Valentim, I. S. et al. Circadian clock disruption engages the DREAM complex in suppressing cellular health. bioRxiv (Cold Spring Harbor Laboratory) (2024). [5]Katsube, M. et al. Food-derived antioxidant ergothioneine improves sleep difficulties in humans. Journal of Functional Foods 95, 105165 (2022). [6]Talavera-Rodriguez, I., Fernandez-Lazaro, C. I., Hernández-Ruiz, Á., Hershey, M. S., Galarregui, C., Sotos-Prieto, M., de la Fuente-Arrillaga, C., Martínez-González, M. Á., & Ruiz-Canela, M. (2023). Association between an oxidative balance score and mortality: a prospective analysis in the SUN cohort. European journal of nutrition, 62(4), 1667–1680. [7]Sarnataro, R., Velasco, C. D., Monaco, N., Kempf, A., & Miesenböck, G. (2025). Mitochondrial origins of the pressure to sleep. Nature, 1-7.
