你有没有想过,为什么有些人能轻松活到100岁,而大多数人却很难突破这个界限?
最近发表在《老年科学》(GeroScience)上的一项研究给出了答案:因为长寿老人基因“变异”了!科学家发现,那些活到94岁以上的长寿老人,体内存在一些罕见的基因变异,而这些基因多和mTOR通路基因相关[1]——这或许就是他们比普通人更长寿的原因。
遗传因素在长寿中的关键作用
我们都知道,长寿是多种因素共同作用的结果。健康饮食、规律运动、良好心态等生活方式固然重要,但科学家们早就发现,遗传因素在决定一个人能否长寿方面扮演着不可忽视的角色。
双胞胎研究表明,长寿的遗传性约为20-30%[2,3],对于活到 85 岁以上的长寿个体,这一比例增加到高达 40% 左右[4]。而对于那些极端长寿(超过100岁)的人群,遗传因素的影响可能更大[5]。
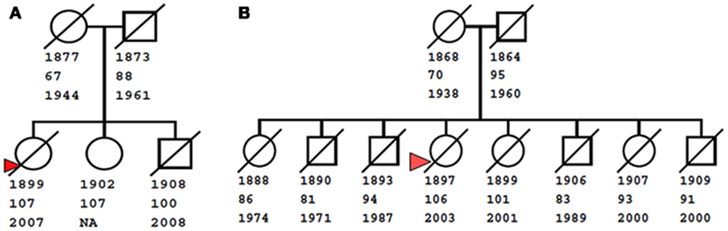
过去几十年里,科学家们已经发现了一些与长寿相关的基因,比如著名的APOE(与阿尔兹海默症相关)和FOXO3基因(与血液系统疾病和衰老相关)[6]。
但这些常见基因变异只能解释部分长寿现象,更多的"长寿密码"仍然隐藏在未被发现的罕见的基因变异中。
这项德国研究[1]的创新之处在于它系统性地分析了长寿老人群体中的罕见基因变异,突破以往只关注常见变异的研究方式。
长寿老人的基因“藏宝图”
这项研究的参与者包括1245名长寿老人(平均年龄98.9岁,其中602人是百岁老人)和4105名健康年轻人(平均年龄50.5岁,范围18-83岁)。研究人员从这些人群的血液样本中提取DNA,并通过基因全外显子测序找出其中的基因变异。
研究人员发现:长寿老人群体的基因中,存在一些与健康年轻人群显著不同的基因变异,尤其是在mTOR通路相关的基因中。
研究发现,长寿老人的基因中存在9个显著的变异,其中RWDD1基因的罕见错义突变(改变蛋白质结构的变异)最为突出。虽然科学家们对这个基因的功能还了解不多,但初步研究表明它可能参与细胞应激反应和能量代谢调控。
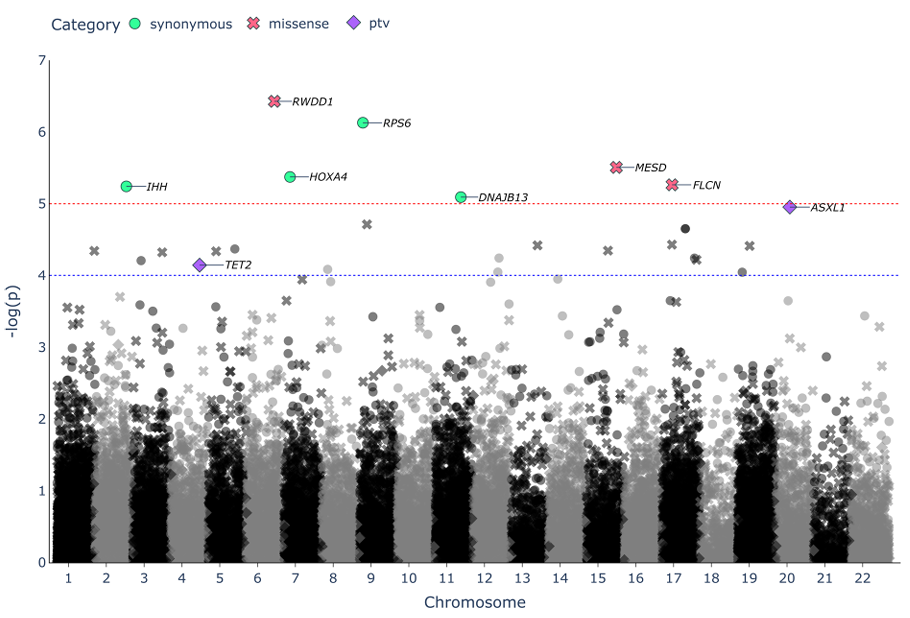
此外,研究者还发现长寿老人携带的基因变异,如RPS6、FLCN和SIK3,均位于mTOR通路中。科学家推测,这些变异可能帮助调控mTOR通路的敏感性,使其在营养和环境变化时,能做出更为精准的反应,从而延缓衰老过程。
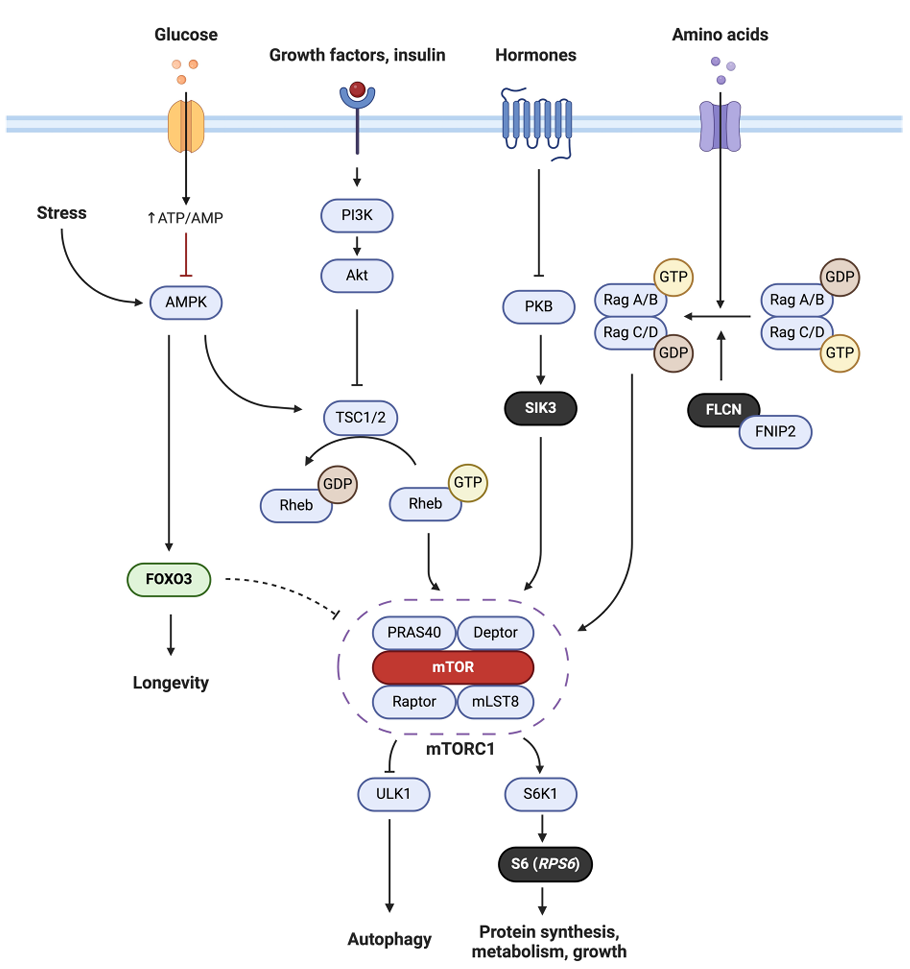
mTOR作为长寿干预的重要通路
提到mTOR,相信关注衰老干预领域的朋友已经很熟悉了,怎么在哪里都能看到他。
mTOR,全称为哺乳动物雷帕霉素靶蛋白,是一种关键的细胞生长和新陈代谢调节因子。它在细胞生长、增殖、蛋白质合成、自噬和营养感应等过程中都起着至关重要的作用。
mTOR通路已经被科学界广泛认可为衰老干预的重要靶标。抑制mTOR活性已经被证明能够延长多种实验动物的寿命[7]。例如,“热量限制延寿法”背后的核心机制,就是通过抑制mTOR的活性,从而延缓衰老。
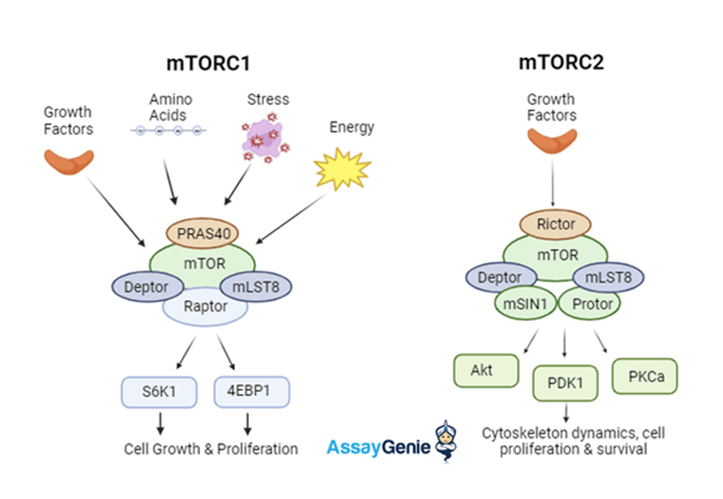
那么,如何抑制mTOR活性呢? 目前最为知名的抑制剂便是雷帕霉素(Rapamycin)。
雷帕霉素是一种免疫抑制药物,能够有效抑制mTOR的活性,从而延长实验动物的寿命。尽管雷帕霉素在延寿方面显示出了显著效果,但它也有一些副作用,因此科学家们一直在寻找更安全、效果更好的mTOR抑制剂,以期能够用于人类的衰老干预。
从基因到实践:我们如何借鉴百岁老人的长寿智慧?
除了热量限制和mTOR抑制剂,科学家们也发现了一些其他的衰老干预方法。
AMPK激动剂
AMPK(腺苷酸活化蛋白激酶)激动剂近年来在衰老干预领域取得了突破。中科院刘光慧团队在灵长类食蟹猴中进行了的实验发现,二甲双胍能显著减缓猴子的衰老速度,并且提高它们的大脑年轻度[8]。
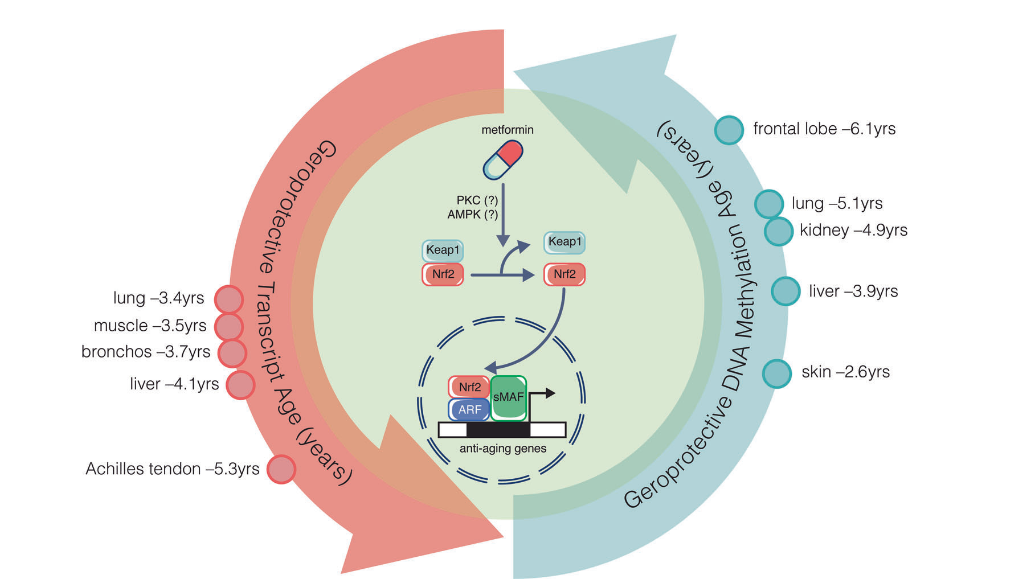
这是因为二甲双胍通过激活AMPK,改变细胞的能量代谢,从而延缓衰老。
AMPK的激活还能影响细胞生长、自噬和炎症等多方面的过程,这些作用与癌症、神经退行性疾病等多种老年病密切相关。
希诺裂(衰老细胞清除剂,Senolytics)
衰老细胞随着年龄增长会在体内积累,这些细胞会分泌一种叫做“衰老细胞分泌表型”(SASP)的物质,促进身体的炎症反应。梅奥诊所的研究团队通过研究发现,清除衰老细胞能够有效逆转衰老过程[9]。
希诺裂(Senolytics)就是一种正在被广泛研究的衰老细胞清除剂,它通过清除衰老细胞,减缓衰老过程。
提升NAD+
NAD+是细胞中的一种重要辅酶,参与细胞呼吸过程中的氧化还原反应,帮助将食物中的能量转化为细胞可以使用的能量——ATP。NAD+是细胞生物过程所必需的,可以说,没有NAD+,细胞就无法工作。
但是随着年龄的增长,NAD+水平逐渐下降,,这不仅会造成线粒体功能障碍[10],还与年龄相关的疾病,如高血压、认知能力下降和 2 型糖尿病等的发展有关,从而加速衰老。
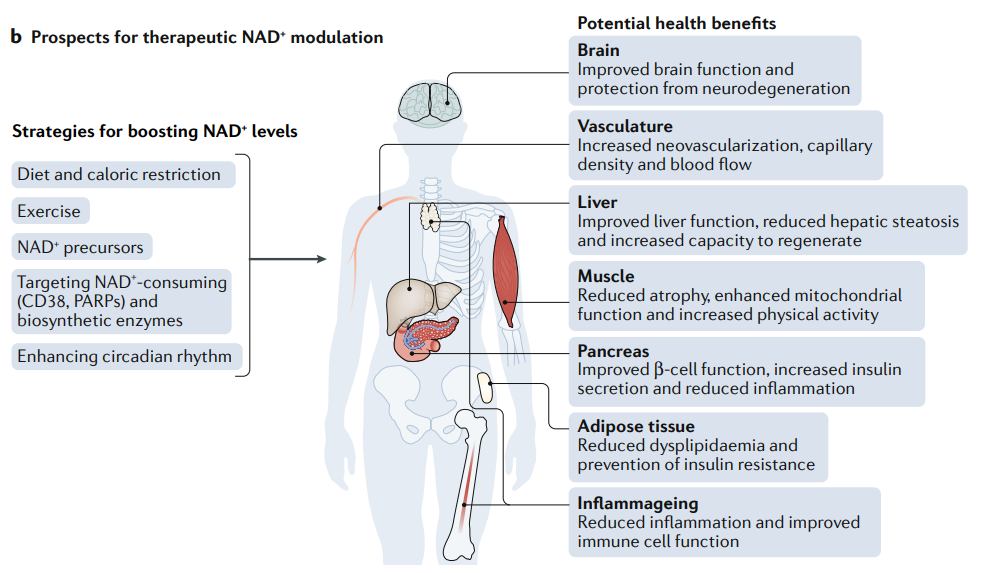
通过补充NAD+前体如NMN和NR,可以有效提高体内的NAD+水平,并在小鼠实验中表现出延长寿命的效果[11,12]。
以上提到的,是目前已知的,我们触手可及最接近长寿的方法。
目前,全球富人都在投资衰老干预领域,不少生物公司也在积极布局。其中在哺乳动物实验中,创下了当前口服衰老抑制剂的新纪录的赛诺根衰老干预药SRN-901及其转化产品瑞拓龄(RESTORIN)即同时整合了mTOR通路抑制和NAD+提升技术,多通路协同干预,为长寿助力。
虽然说基因在一定程度上影响着我们的寿命,但我们也不必悲观。今年2月一项发表在《自然·医学》上的研究,对50万人的数据进行了分析,认为生活方式、生活条件等后天环境暴露因素对衰老、寿命的影响要比基因更大[13]。
所以,除了药物干预,健康的生活方式仍然是我们延长寿命、保持活力的关键。合理的饮食、适度的运动以及良好的心理状态,都是影响我们长寿的不可忽视的因素。未来,或许我们可以通过结合遗传学和生活方式的优化,走向更加健康和长寿的未来。
参考资料:
[1]Kolbe, D. et al. German longevity study reveals novel rare pro-longevity alleles clustering in mTOR signaling pathway. GeroScience (2025) doi:10.1007/s11357-025-01640-7.
[2]Herskind, A. M. et al. The heritability of human longevity: A population-based study of 2872 Danish twin pairs born 1870–1900. Human Genetics 97, 319–323 (1996).
[3]Skytthe, A. et al. Longevity Studies in GenomEUTWin. Twin Research 6, 448–454 (2003).
[4]McDaid, A. F. et al. Bayesian association scan reveals loci associated with human lifespan and linked biomarkers. Nature Communications 8, (2017).
[5]Sebastiani, P. & Perls, T. T. The Genetics of Extreme Longevity: Lessons from the New England Centenarian Study. Frontiers in Genetics 3, (2012).
[6]Deelen, J. et al. A meta-analysis of genome-wide association studies identifies multiple longevity genes. Nature Communications 10, (2019).
[7]Mannick JB, Lamming DW. Targeting the biology of aging with mTOR inhibitors. Nature Aging. 2023;3(6):642-660.
[8]Yang Y, Lu X, Liu N, et al. Metformin decelerates aging clock in male monkeys. Cell. 2024;187(22):6358-6378.e29.
[9]Xu M, Pirtskhalava T, Farr JN, et al. Senolytics improve physical function and increase lifespan in old age. Nature Medicine. 2018;24(8):1246-1256.
[10]Gomes AP, Price NL, Ling AJY, et al. Declining NAD+ Induces a Pseudohypoxic State Disrupting Nuclear-Mitochondrial Communication during Aging. Cell. 2013;155(7):1624-1638.
[11]Fang, E. F. et al. NAD + replenishment improves lifespan and healthspan in ataxia telangiectasia models via mitophagy and DNA repair. Cell Metabolism 24, 566–581 (2016).
[12]Zhang, H. et al. NAD + repletion improves mitochondrial and stem cell function and enhances life span in mice. Science 352, 1436–1443 (2016).
[13]Argentieri, M. A. et al. Integrating the environmental and genetic architectures of aging and mortality. Nature Medicine (2025) doi:10.1038/s41591-024-03483-9.
Cover designed by Freepik.
