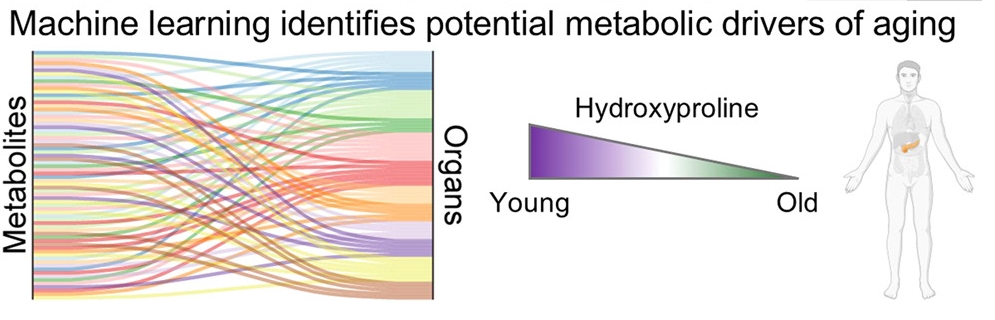
一年又一年的年岁增加,身体也会同步衰老吗?或者说,我们身体中的各个“零件”真的与自己同龄吗?如果你很关注“变老”这件事,那你一定听说过人体器官有一个“衰老时间表”,也就是各器官的衰老节点并不相同。 不仅如此,从人类血浆蛋白质组评估器官年龄,到非人灵长类动物多器官图谱,科学家们反复证实:我们体内的器官,老化速度也各不相同[1-3]。而最新的科学研究正在将这张表精确到分子级别,对我们的延寿计划会有影响吗? 今年7月,中国科学院动物研究所、国家生物信息中心和四川大学华西医院团队发表在国际顶刊《Cell》上的一项研究,系统绘制了首张覆盖人类50年生命周期的“蛋白质组衰老图谱”[4]。 研究人员分析了76名14-68岁人群的13种器官组织样本,从超1.2万种蛋白质的动态变化中,捕捉到了衰老的真正轨迹。具体来说,有以下几个主要发现: 研究发现,人体器官的衰老并非齐头并进,而是有清晰的先后顺序: 30岁左右是衰老轨迹的初始分水岭。内分泌稳态的早期失衡,可能是全身衰老的初始驱动力。 45-55岁则是关键的“衰老转折点”。此时绝大多数器官的蛋白质组发生剧烈改变,系统性衰老全面启动。 器官特异性“蛋白质组衰老时钟”显示,主动脉在30岁已显著“超龄”,远早于其他组织。研究人员表示,血管不仅是衰老的受害者,更是调控全身衰老进程的“核心枢纽”,驱动并放大全身多器官的系统性衰老进程。 如果说上面这项研究提供了器官衰老的“分子时刻表”,那么11月25日发表在《细胞·代谢》上的新研究,则从代谢变化层面解释了器官衰老差异产生的内在生化原因[5]。 美国南加州大学、密歇根大学安娜堡分校、麻省理工学院等机构合作的研究团队,对5个年龄段小鼠(相当于人类的12、20、56、62、80岁左右)的12个器官进行了代谢变化分析,包括血浆、心脏、肝脏、肾脏、脑、肺、脾、胸腺、舌头、股四头肌、胰腺和膀胱。 新研究不仅首次在多个器官、雄雌两性中全面描绘了代谢衰老图谱,还发现了几个关键点: 研究人员发现,不同器官在衰老过程中代谢物变化幅度差异巨大。 胸腺是衰老变化最剧烈的器官:至少44.2%的代谢物水平都发生了显著变化。这一点并不让人意外,因为胸腺是众所周知的会随年龄显著退化的器官,即“胸腺萎缩”。 大脑则显得“情绪”稳定很多——只有7.6%的代谢物发生显著变化。也就是说,大脑在维持内部化学环境稳定方面具有强大能力。 甚至同一类组织也遵循不同路径。股四头肌有44%的代谢物发生变化,而舌头仅有14%,这大概能够从分子层面解释为什么会“人老腿先老”。 在这项研究中,每个年龄组都包含7只雄性小鼠和7只雌性小鼠。因此,研究结果显示出,雄性和雌性小鼠的多个器官都沿着不同的代谢路径衰老。简单说就是,性别也会影响器官代谢。 心脏:雄性心脏中,参与甲硫氨酸代谢的5’-甲基硫代腺苷和S-腺苷同型半胱氨酸水平,在生命各阶段均高于雌性;雌性心脏中,谷胱甘肽还原型与氧化型的比值更高。这可能与雄性更易发生心血管疾病有关。 反式-4-羟脯氨酸在12个被检器官中的11个(除大脑外)均随衰老显著下降,且这一趋势在人类胰腺组织中得到了验证。羟脯氨酸是胶原蛋白的关键成分,普遍下降表明,全身性细胞外基质重塑失调,可能是多器官功能衰退的共同机制。 基于血浆代谢物数据,研究者成功构建了一个机器学习模型(预测准确率达0.9),仅用8种代谢物就能高精度地预测小鼠的生理年龄。其关键因子α-酮戊二酸(AKG),此前已被研究证实,通过膳食补充能延长小鼠健康寿命。 这个代谢时钟的厉害之处在于——不仅能够“报时”,还可能指认出驱动衰老的“元凶”之一。AKG既随衰老减少,又能预测年龄,还能通过补充来延寿,俨然成为一个极具潜力的衰老干预靶点。 看完这两项研究后,我们要先明确一点:衰老不是笼统而模糊的概念,同时也没有脱离器官衰老的整体衰老。 所以,我们在规划个人的“长寿行动”时,应以早期干预与血管系统保护、改善全身代谢状态、控制系统性慢性炎症为核心策略,并从以下几方面建议。 建立健康监测:从30岁起,应定期监测血压、血糖、血脂等基础指标,建立个人健康档案。 尽早养成多元运动习惯:每周进行至少150分钟的中等强度有氧运动,如快走、游泳或骑行,保护心血管健康;逐渐增加每周2次的力量训练,重点是维持肌肉量和骨密度;再逐渐将有氧运动与高强度间歇训练(HIIT)结合,提升线粒体功能和代谢灵活性。 优化饮食模式:日常尽量以地中海饮食为模板,增加蔬菜、水果、全谷物、坚果、橄榄油和鱼类的摄入,减少加工食品和添加糖。需要进一步优化的选手,可在专业营养师或医生指导下,尝试限时进食,比如“16+8”法。有助改善代谢健康,减少身体炎症。 合理使用补剂:尽管通过技术手段干预衰老已成为大部分中产以上群体的一种选择,但对于研究热点物质如AKG、NAD+前体等补剂,目前仍属前沿探索阶段,选择时需谨慎,务必咨询医生或临床营养师,并优先通过整体生活方式改善代谢。 保证优质睡眠:维持每晚7-8小时的高质量睡眠,建立规律的作息时间表。 有效管理压力:通过冥想、正念、社交活动等方式管理慢性压力,避免长期处于高压状态。 真正的衰老干预不能依赖单一方法,而是要将上述策略整合到自己的生活方式当中。未来,通过一次简单的血液检测,我们就能评估身体多个系统的“代谢年龄”,实现器官特异性的、早期的健康预警。 器官衰老从30岁开始,在50岁加速

器官衰老有自己的“时刻表”
血管是衰老的“枢纽”
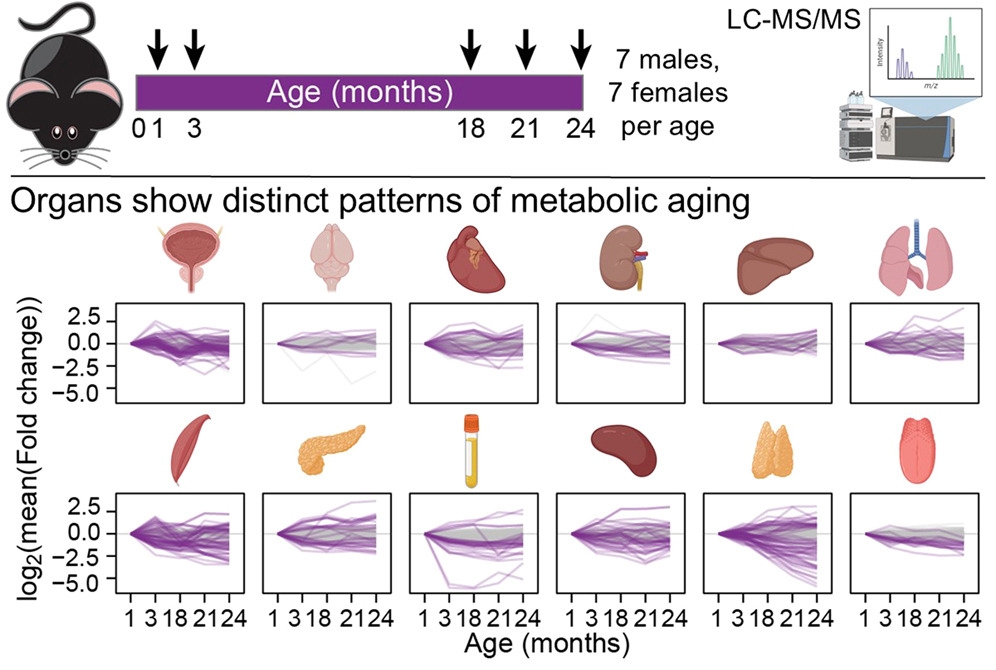
每个器官衰老的方式都不同

各器官有自己的代谢衰老轨迹
衰老存在普遍且显著的性别差异
肝脏:在雌性及其他器官中普遍下降的反式-4-羟脯氨酸,在雄性肝脏中反而上升,说明两性的组织纤维化过程可能遵循不同时钟。
胸腺:在18月龄时,雌性小鼠的胸腺代谢特征更接近年轻小鼠,而雄性则已迈入“老年代谢模式”,符合临床上雄性胸腺更早萎缩现象。锁定跨器官衰老标志物
构建“血浆代谢衰老时钟”
延缓器官衰老应该怎么做?

参考资料:
[1] Oh HSH, Rutledge J, Nachun D, et al. Organ aging signatures in the plasma proteome track health and disease. Nature. 2023;624(7990):164-172. doi:10.1038/s41586-023-06802-1
[2] Xiao S, Jiang R, Liu Y, et al. Organ-specific proteomic aging clocks predict disease and longevity across diverse populations. Nature Aging. November 2025. doi:10.1038/s43587-025-01016-8
[3] Li GH, Zhu XQ, Xiao FH, et al. A multi-omics molecular landscape of 30 tissues in aging female rhesus macaques. Nature Methods. November 2025. doi:10.1038/s41592-025-02912-y
[4] Ding Y, Zuo Y, Zhang B, et al. Comprehensive human proteome profiles across a 50-year lifespan reveal aging trajectories and signatures. Cell. 2025;188(20):5763-5784.e26. doi:10.1016/j.cell.2025.06.047
[5] Pilley SE, Awad D, Latumalea D, et al. A metabolic atlas of mouse aging. Cell Metabolism. November 2025. doi:10.1016/j.cmet.2025.10.016
