经常关注饮食和健康的人一定听过一句话:“You are what you eat.”用人话说就是:我们的身体记录着每一口食物的信息,并且会在多年后显现结果。因此,在“畏老”之风的吹动下,怎么吃能延缓衰老不仅是百姓感兴趣的话题,更是早就成了科学界关注的重点。

然而,科学研究有时也会出现看似矛盾的结论。比如,10月份发表的两篇顶刊研究,一个说低蛋白饮食可能具有延缓衰老的潜力,而另一个则表示,瘦肉、鸡蛋、豆类中的半胱氨酸可以减缓肠道老化。总的来说,我们餐桌上的肉蛋奶,不仅关乎营养,也可能在悄然影响我们的衰老进程。
低蛋白饮食的多维衰老干预效果
10月24日,西湖大学郭天南团队在《Cell》上发表研究,通过追踪小鼠“一生饮食日记”以及人类饮食调研,发现限制蛋白质摄入可能具有延缓衰老的潜力,中年或是最佳窗口期[1]。

研究人员对实验小鼠进行了长达两年的全生命周期追踪——差不多相当于小鼠的整整一生,并在三个年龄段——青年、中年、老年(分别对应人类年龄的32-38岁、43-49岁和60-67岁)对小鼠进行为期3个月的蛋白质限制干预,即蛋白质分别占比40%、20.7%和5%。随后,结合人类血浆样本,对衰老与蛋白质限制的关系进行了系统分析。
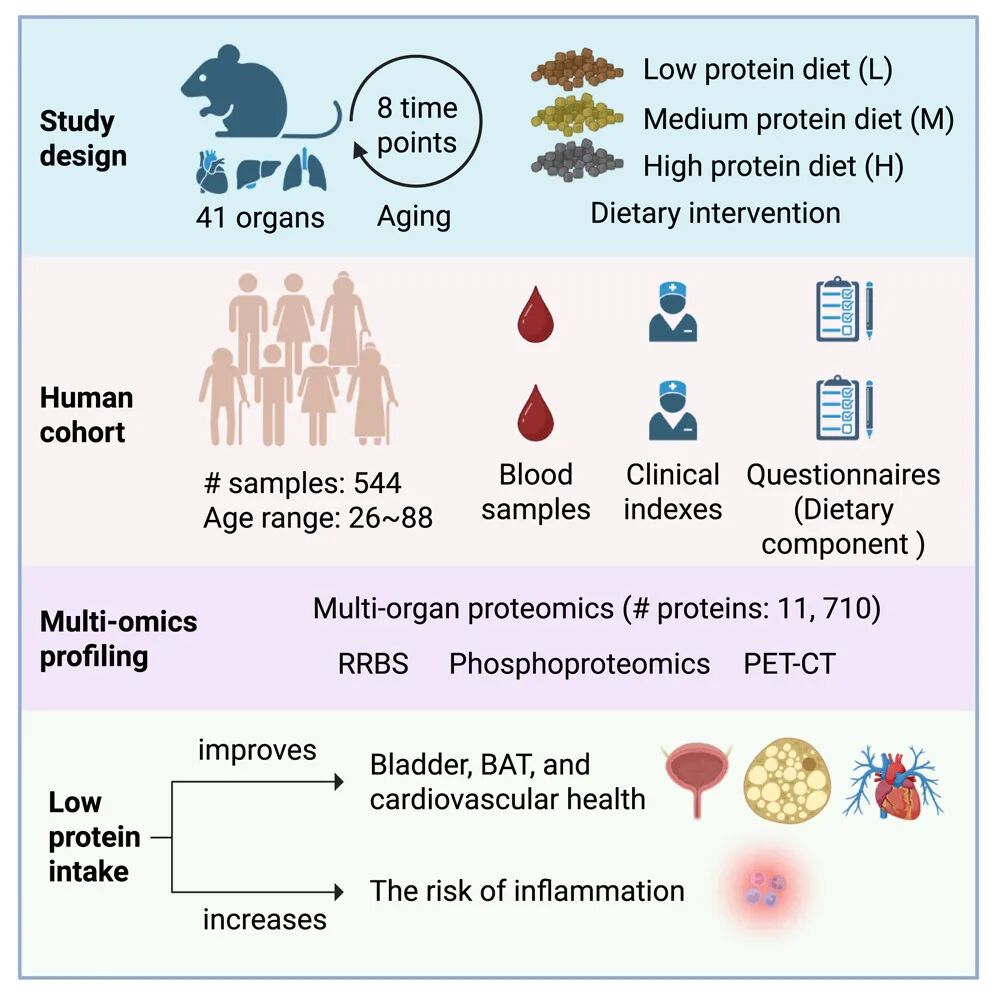
结果发现,在低蛋白饮食组中,因衰老而减少的22个蛋白质变化被逆转了,且个体表现出更健康的脂肪组织、更年轻的肾脏状态以及更低的癌症风险。不仅如此,低蛋白饮食还能调控AMPK信号通路,增强葡萄糖摄取和脂代谢,尤其中年小鼠对蛋白质限制的反应最显著。也就是说,中年时期可能是实施蛋白质限制的最佳窗口期。
进一步对272人血液样本的分析验证,低蛋白饮食可以改善人类血糖、血脂、心血管健康,并有助于延长寿命。
半胱氨酸:来自蛋白质饮食中的“肠道修复器”
当郭天南团队专注于蛋白质总量与衰老关系时,10月1日,《Nature》上则发表了膳食半胱氨酸的惊人功能——修复肠道屏障,使肠道始终保持新鲜的活力[2]。

半胱氨酸是一种半必需氨基酸,我们的身体通常可以自己合成,但在特定生理条件下无法合成足够量,因此需要通过摄入瘦肉、鸡蛋以及豆类进行额外补充。
麻省理工学院的这项研究表明,饮食来源的半胱氨酸有助于肠道上皮细胞中辅酶A(CoA)的生物合成,这促进了上皮内CD8αβ+T细胞的扩增,并让它们出乎意料地分泌白细胞介素-22(IL-22),而IL-22是肠道干细胞增殖的关键介质,负责组织修复和屏障维护。
简单来说就是,从高蛋白食物中获取的半胱氨酸能够增强肠道损伤后肠道干细胞介导的肠道再生。
表面矛盾背后的科学逻辑
这两项研究不免会让人感到疑惑:一项研究说低蛋白饮食有益健康,另一项则说某种氨基酸(蛋白质的基本组成单位)有修复功能。这不是自相矛盾吗?
实际上,这两项研究从不同角度揭示了蛋白质与健康的复杂关系,并不存在真正的矛盾:
蛋白质总量与特定氨基酸的区别:郭天南团队研究关注的是蛋白质总量摄入与衰老的关系,而麻省理工学院的研究则聚焦于一种特定氨基酸的功能。这是整体与局部的关系。
不同生命阶段的不同需求:郭天南团队发现中年可能是蛋白质限制的最佳时期,但这并不意味着所有年龄段都需要同样程度的限制。麻省理工学院的研究可能暗示,对老年人来说,通过饮食适量获取半胱氨酸,或许可以让沉睡的干细胞“苏醒”,减缓肠道老化,但这需要开展更多针对老年人的进一步验证。
健康状况决定需求差异:麻省理工学院的研究特别关注肠道损伤修复,这对于接受放化疗的癌症患者尤其重要。而郭天南团队的研究则更关注长期的衰老过程。
平衡之道:蛋白质摄入的科学策略
基于这两项研究,长寿之家changshou.com总结了几点关于蛋白质的饮食建议:
1.尽量遵循膳食指南建议
《中国居民膳食指南(2022)》建议,普通成年人(轻体力活动者)每日蛋白质推荐摄入量为男性65克、女性55克,相当于每公斤体重摄入1.0-1.2克。另外,蛋白质应优先选择鱼、禽、蛋、奶、豆类等优质来源,并注意三餐均衡分配。
2.个体化调整
首先,对于正在接受放化疗或有肠道损伤风险的人群,适当增加富含半胱氨酸的食物可能有助于肠道修复。其次,在健康人群中,中年阶段(40-50岁左右)适度减少蛋白质的摄入,老年阶段可适当多吃点。
3.植物蛋白与动物蛋白的平衡

荷兰阿姆斯特丹大学近日发表的研究表明,过量摄入动物蛋白不利于老年人的认知健康,而植物蛋白更益大脑健康[3]。
4.避免极端饮食
郭天南团队在研究中提醒,极低蛋白摄入可能导致脂肪肝和肝细胞衰老、增加炎症风险。因此,蛋白质摄入太少甚至完全不吃也不可取。
在追求健康长寿的道路上,蛋白质平衡或许是一条有科学依据的路径,但关键在于“适度”而非“极端”。在匆匆改变饮食习惯前,不妨看看我们上面的建议。
参考资料:
[1] Lu T, Xie Y, Wang Y, et al. Protein restriction reprograms the multi-organ proteomic landscape of mouse aging. Cell. October 2025.
[2] Chi F, Zhang Q, Shay JES, et al. Dietary cysteine enhances intestinal stemness via CD8+ T cell-derived IL-22. Nature. October 2025.
[3] Peperkamp M, Olthof MR, Visser M, Wijnhoven H a. H. The association between total, animal-based, and plant-based protein intake and cognitive decline in older adults. European Journal of Nutrition. 2025;64(7).
