随着年龄增长,大脑功能衰退与脑血管系统的退化密切相关。近日《老年科学》上发表的一篇综述研究发现,血液中的全身性因子在调控脑衰老过程中发挥着关键作用[1],其中烟酰胺腺嘌呤二核苷酸(NAD+)作为核心代谢分子,通过维持血管内皮功能、保护血脑屏障完整性及激活长寿蛋白Sirtuins等机制,成为对抗大脑衰老的关键靶点。
NAD+的流失与大脑衰老
营养感知通路在调节衰老过程中起着核心作用,包括mTOR(雷帕霉素的哺乳动物靶标)、AMPK(AMP活化蛋白激酶)、胰岛素/ IGF-1信号传导和sirtuins。这些通路共同构成了一个精密的衰老调控网络,而NAD+正是这个网络中不可或缺的"能量货币"。
随着年龄增长,NAD+水平的下降已成为一个公认的衰老标志。人体内NAD+水平到中年时下降到不到年轻水平的 50% [2]。这种下降不仅影响能量代谢,更会扰乱整个营养感应网络的平衡,进而加速大脑衰老进程。
研究发现,血液中的全身性调节因子,也称为循环因子,与脑血管和脑衰老密切相关。这是因为老年血液中存在着“促衰老因子”,能够通过调节营养感知通路来加速衰老进程。
有“促衰老因子”,自然就有“抗衰老因子”,美国硅谷换血富豪布莱恩·约翰逊(Bryan Johnson)就曾用儿子的年轻血浆重焕青春。

在动物实验中,异体共生实验(Heterochronic parabiosis)就是通过将年轻和老年动物的血液循环系统相连,发现年轻血液可以部分逆转老年动物的认知功能衰退[3],并提高脑微血管内皮细胞的NAD+水平[4]。
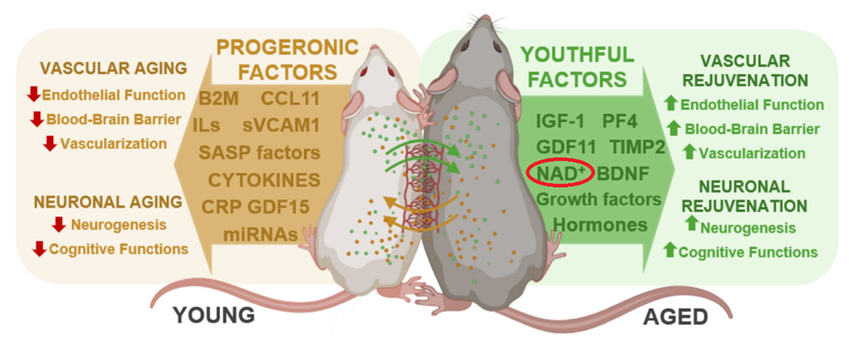
这一发现也说明了NAD+ 的流失对于大脑衰老的影响,同时也提醒了我们,通过提升NAD+以对抗大脑衰老的科学性。
NAD+如何守护大脑
那么,抗老因子NAD+是如何行使使命的呢?
NAD+能够通过多种机制保护大脑免受衰老带来的损伤,其中最重要的是其对血管系统和神经细胞的保护作用。
NAD+增强血管内皮功能,恢复脑血管健康
血管内皮功能障碍是脑衰老的重要特征,表现为血管舒张能力下降、氧化应激增加和慢性低度炎症。
而研究发现,补充NAD+前体NMN(烟酰胺单核苷酸),可以激活SIRT1(依赖NAD+的去乙酰化酶)改善内皮功能,促进一氧化氮(NO)的生成,从而维持血管舒张能力,逆转小鼠的血管功能障碍,保护脑血管内皮细胞免受氧化损伤[9]。
NAD+挽救神经血管耦合反应,改善认知功能
神经血管耦合(NVC)可以根据神经元活动来调整脑血流(CBF),这在维持健康的认知功能方面起着至关重要的作用。但是,这一过程在衰老过程中受损。
研究发现,在小鼠衰老模型中,使用 NAD+ 前体 NMN 进行短期治疗可挽救 NVC 反应并改善小鼠的认知功能缺陷[10]。
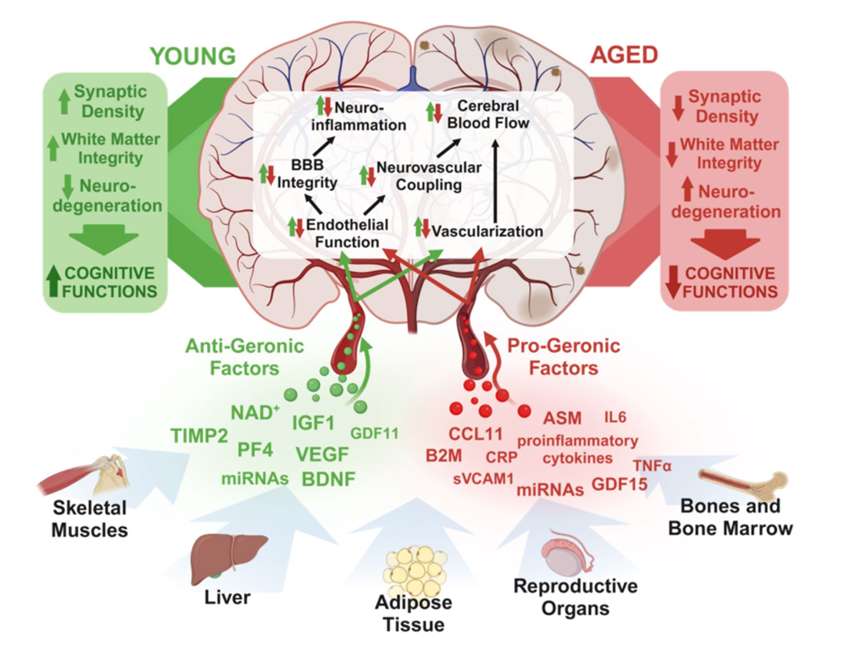
NAD+修复脑血管功能,维持血脑屏障完整性
血脑屏障(BBB)的功能是保护大脑免受血源性毒素的侵害,并且对认知功能至关重要。但是血脑屏障功能在衰老过程中不断恶化,最终导致认知障碍和神经退化。目前尚不清楚是什么原因导致衰老过程中 BBB 泄漏以及如何预防。
研究表明,补充NMN,提升NAD+可以在小鼠中挽救衰老诱导的血脑屏障损伤[11]。
综上,NAD+作为关键的抗衰老分子,通过维护血管健康、优化脑血流调节以及加固血脑屏障,全方位守护大脑功能。而通过补充NAD+前体NMN、NR不仅有助于延缓脑血管衰老,还有益于改善认知能力。
运动与热量限制:NAD+提升的自然方式
除了直接补充NAD+前体,生活方式干预,如运动和热量限制(CR),也能有效提升NAD+水平,并带来对抗大脑衰老的益处。
热量限制(CR)与NAD+提升
热量限制(CR)是指减少热量摄入而不造成营养不良的饮食状态,已被证明能延长多种模式生物的寿命[5]。研究发现,CR能够诱导血浆循环因子的有利变化,包括NAD+水平升高和促炎细胞因子水平降低,这都有助于其脑血管保护作用[6]。
除此之外,CR还能通过激活AMPK和抑制mTOR信号通路,促进自噬,利于衰老过程中维持细胞稳态[12,13]。

运动与NAD+代谢
运动是另一种天然提升NAD+的方式。
eNAMPT(细胞外NAMPT)是一种对NAD+生物合成至关重要的酶。研究表明,运动会刺激含有eNAMPT的细胞外囊泡(EVs)的释放,从而增强受体细胞中的 NAD+ 水平和SIRT1活性[7]。此外,运动还能上调肌肉和脑组织中的NAMPT表达,促进NAD+的合成[8]。
这些发现揭示了潜在的运动抗衰机制,不仅可以抵消与年龄相关的NAD+下降,还能促进Sirtuin激活,为运动预防脑衰老提供了分子基础。
从实验室到临床:NAD+干预策略
目前,补充NAD+前体(如NMN、NR)已成为衰老干预研究的热点。
大量临床前研究表明,NMN能显著提高老年动物的NAD+水平,有效改善认知功能并减少神经退行性病变。初步临床试验也证实,NMN/NR在人体中具有良好的安全性,并对神经退行性疾病和认知功能具有潜在改善作用[14,15]。
NAD+代谢调控为对抗大脑衰老提供了新的干预靶点。值得注意的是,由于大脑是人体最复杂的器官,单一靶点的干预可能不足以应对脑衰老的复杂性。

因此,未来研究应重点关注以下方向:一方面需要探索将衰老干预疗法与衰老相关疾病治疗相结合,例如将恢复NAD+水平的疗法与维持血脑屏障完整性的疗法联合应用,有望增强对中枢神经系统的协同保护作用,促进神经退行性疾病患者的康复。
另一方面,大脑衰老干预研究趋势将将朝着多通路协同干预的方向发展。通过整合NAD+提升、希诺裂疗法(衰老细胞清除剂,senolytics)、代谢调节和生活方式干预(如运动、热量限制)等多种策略,有望产生显著的协同效应。
这种综合干预模式不仅能克服单一靶点的局限性,还能有效减少脱靶效应和累积毒性,从而全面提升抗衰老治疗的整体效果。
随着NAD+提升与希诺裂等突破性研究的涌现,大脑的衰老也许并非是不可逆转的命运。
这场关于"最强大脑"的保卫战,科学正在逐渐赢得主动权。
参考资料:
[1]Gulej, R. et al. Impacts of systemic milieu on cerebrovascular and brain aging: insights from heterochronic parabiosis, blood exchange, and plasma transfer experiments. GeroScience (2025) doi:10.1007/s11357-025-01657-y. Online ahead of print.
[2]Palmer, D. et al. Precursor comparisons for the upregulation of nicotinamide adenine dinucleotide. Novel approaches for better aging. Aging Med (Milton). 2021 Aug 4;4(3):214-220.
[3]Villeda, S. A. et al. Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice. Nature Medicine 20, 659–663 (2014).
[4]Kiss, T. et al. Circulating anti-geronic factors from heterochonic parabionts promote vascular rejuvenation in aged mice: transcriptional footprint of mitochondrial protection, attenuation of oxidative stress, and rescue of endothelial function by young blood. GeroScience 42, 727–748 (2020).
[5]Csiszar, A. et al. Anti-oxidative and anti-inflammatory vasoprotective effects of caloric restriction in aging: Role of circulating factors and SIRT1. Mechanisms of Ageing and Development 130, 518–527 (2009).
[6]Späth, M. R. et al. Organ protection by caloric restriction depends on activation of the de novo NAD+ synthesis pathway. Journal of the American Society of Nephrology 34, 772–792 (2023).
[7]Chong MC, Silva A, James PF, Wu SSX, Howitt J. Exercise increases the release of NAMPT in extracellular vesicles and alters NAD(+) activity in recipient cells. Aging Cell. 2022;21:e13647.
[8]Prattichizzo F, Giuliani A, Sabbatinelli J, Mensa E, De Nigris V, La Sala L, de Candia P, Olivieri F, Ceriello A. Extracellular vesicles circulating in young organisms promote healthy longevity. J Extracell Vesicles. 2019;8:1656044.
[9]Picciotto, N. E. et al. Nicotinamide mononucleotide supplementation reverses vascular dysfunction and oxidative stress with aging in mice. Aging Cell 15, 522–530 (2016).
[10]Tarantini, S. et al. Nicotinamide mononucleotide (NMN) supplementation rescues cerebromicrovascular endothelial function and neurovascular coupling responses and improves cognitive function in aged mice. Redox Biology 24, 101192 (2019).
[11]Zhan, R. et al. NAD+ rescues aging-induced blood-brain barrier damage via the CX43-PARP1 axis. Neuron 111, 3634-3649.e7 (2023).
[12]Chen, C., Zhou, M., Ge, Y. & Wang, X. SIRT1 and aging related signaling pathways. Mechanisms of Ageing and Development 187, 111215 (2020).
[13]Rakshe, P. S., Dutta, B. J., Chib, S., Maurya, N. & Singh, S. Unveiling the interplay of AMPK/SIRT1/PGC-1α axis in brain health: Promising targets against aging and NDDs. Ageing Research Reviews 96, 102255 (2024).
[14]Yulug, B. et al. Multi-omics characterisation of improved cognitive functions in Parkinson’s disease patients after the combined metabolic activators treatment: a randomised, double-blinded, placebo-controlled phase-II trial. Brain Communications 7, (2024).
[15]Vreones, M. et al. Oral nicotinamide riboside raises NAD+ and lowers biomarkers of neurodegenerative pathology in plasma extracellular vesicles enriched for neuronal origin. Aging Cell 22, (2022).
Cover designed by freepik.
