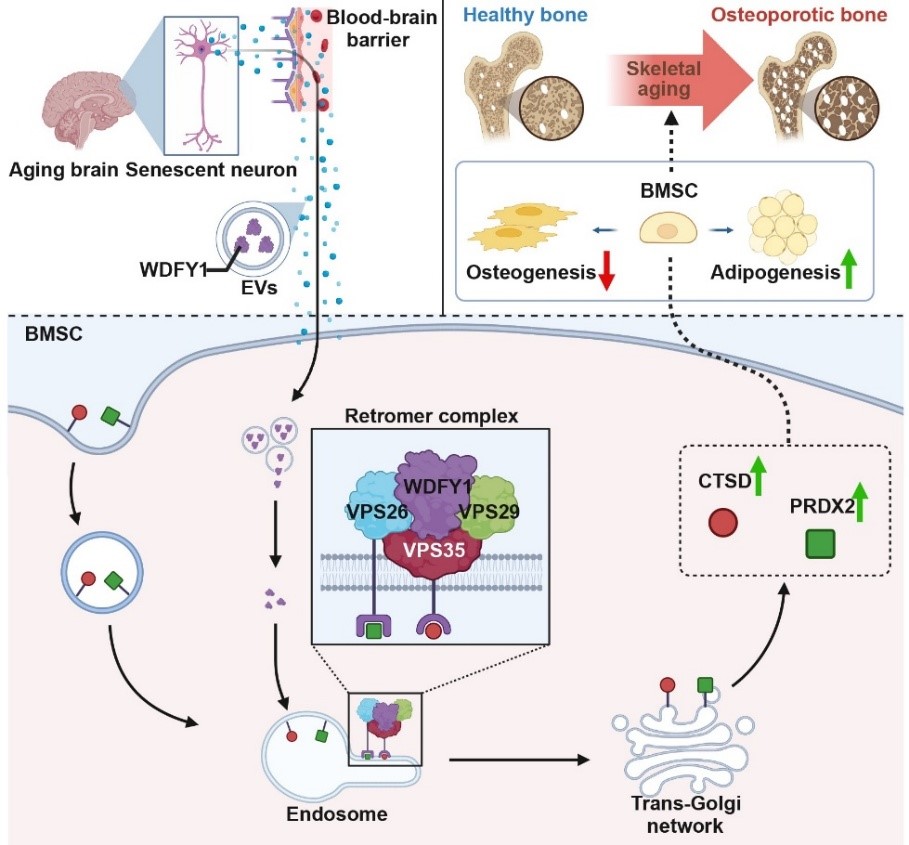
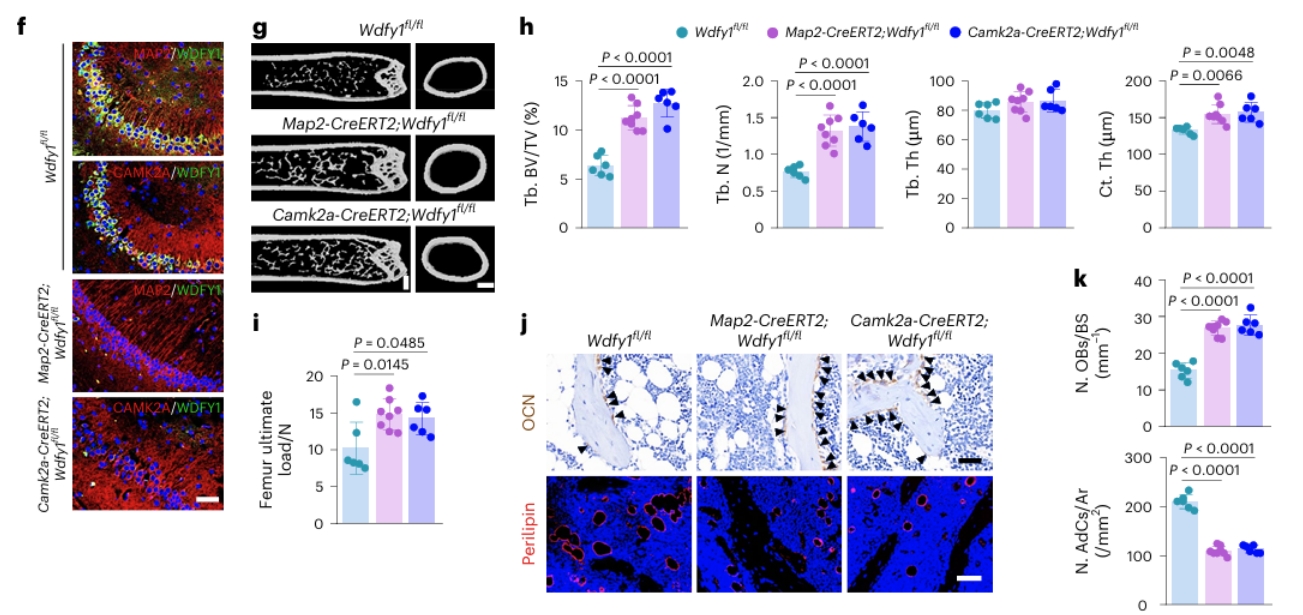
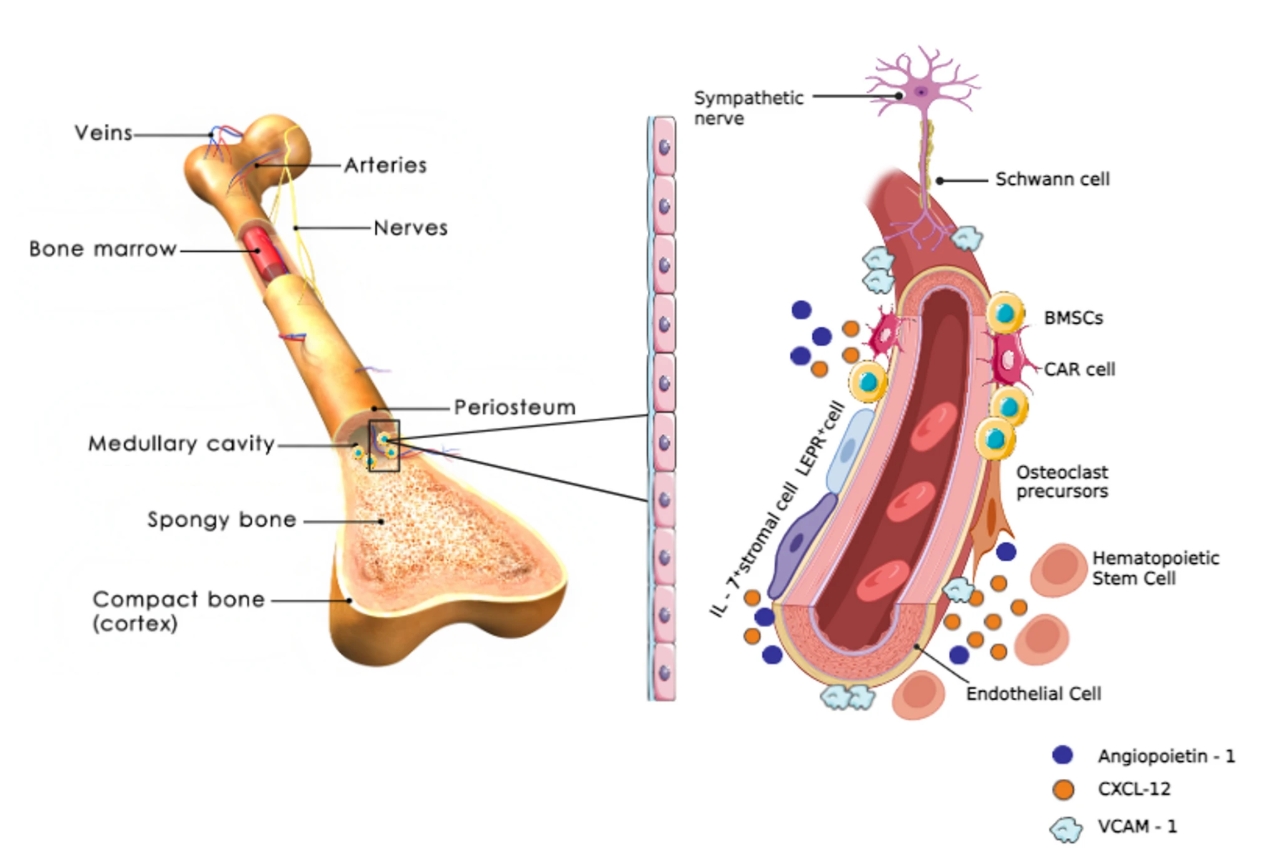
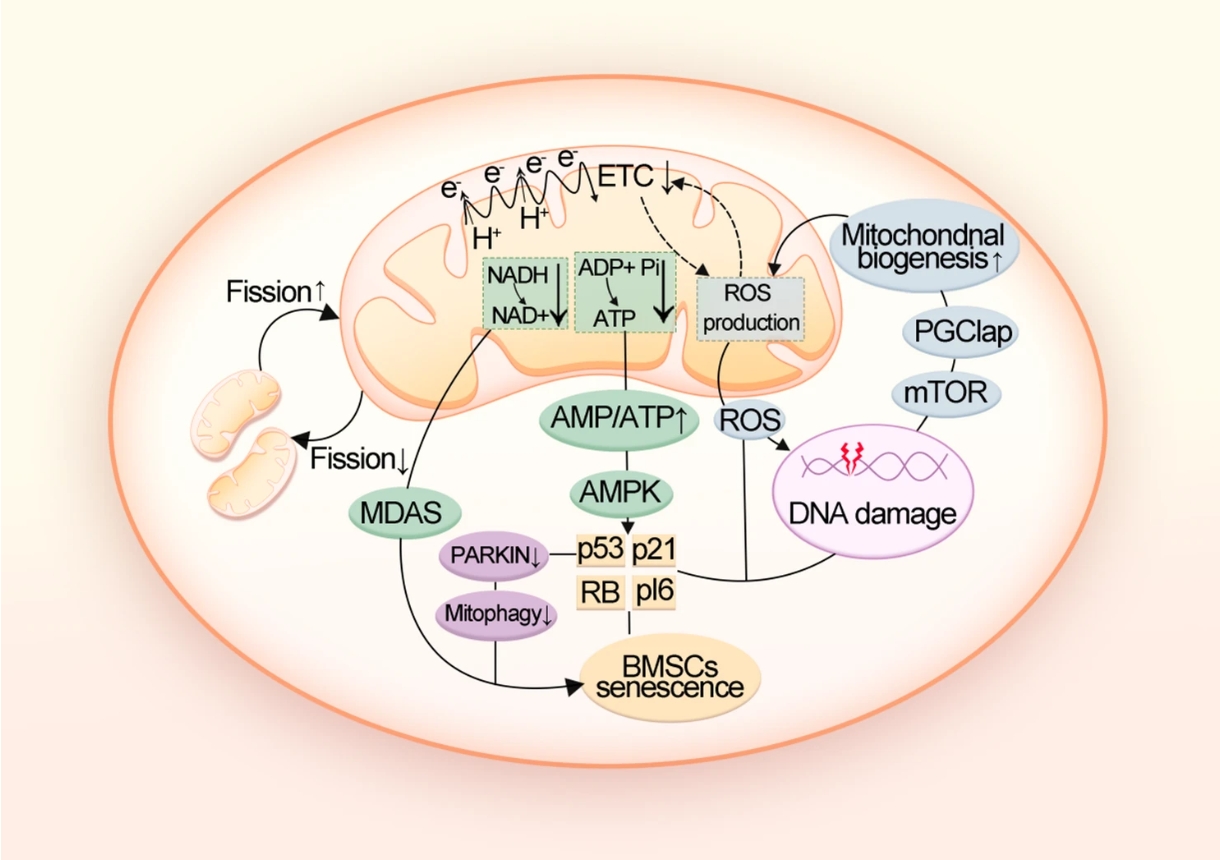
人在步入老年后,常常同时面临两个看似独立的问题:记忆力下降、反应变慢等大脑功能衰退,以及身高缩短、骨折风险增加的骨骼系统老化。传统医学将其视为平行发生的、互不关联的衰老表现,但最新研究发现,大脑与骨骼之间存在持续不断的“对话”,而衰老会扭曲这种对话的内容。 2026年,中南大学湘雅医院谢辉、饶珊珊与陈春媛博士团队在顶级期刊《自然·衰老》上发表了一项研究,首次证实:衰老的大脑神经元会主动释放一种特殊信号,远程指挥骨骼“少造骨头,多囤脂肪”[1]。 与此同时,南京鼓楼医院的王斌团队则在《干细胞研究与治疗》杂志上发表了一篇系统性综述,全面梳理了骨骼内部“维修工”——骨髓间充质干细胞(BMSCs)的衰老过程,记录了这些细胞如何从“积极活跃”变为“消极怠工”的状态,甚至开始“破坏工作环境”[2]。 这两项研究,一项发现了远程的“错误指令”,一项记录了内部的 “执行混乱”,但却共同构建出了我们对骨骼衰老的完整认识:骨骼健康不仅取决于骨骼本身,还受到整个机体、特别是大脑的系统性调控。 谢辉团队的研究将焦点对准了一个器官间通讯载体:细胞外囊泡。想象一下,每个细胞都能释放出微小的“包裹”,这些包裹携带着特定的蛋白质、核酸等生物活性物质,进入血液循环后,可以被远端的细胞接收并解读。 在年轻、健康的大脑中,这种通讯系统维持着器官间的和谐平衡。但随着衰老,通讯内容发生了病理性改变。研究人员发现,在衰老的大脑神经元释放的细胞外囊泡中,一种名为WDFY1的蛋白质含量异常增高。 在追踪这些囊泡的去向后,研究人员发现,这些从衰老大脑出发的囊泡,确实能够通过血液循环,“精准投递”到骨骼组织中。重要的是,当这些富含WDFY1的囊泡被骨髓间充质干细胞(BMSCs)接收后,会触发一系列基因表达变化,最终诱导骨质流失。 正常情况下,BMSCs可以分化为成骨细胞(负责造骨)或脂肪细胞(负责储存脂肪),而在接收到WDFY1蛋白信号后,就会关闭成骨基因的表达,同时打开成脂基因的开关。 动物实验进一步证实了这一机制。研究人员通过基因技术降低老年小鼠大脑神经元中WDFY1的表达,或阻断这些囊泡的释放后,小鼠的骨骼健康状况明显改善:骨量增加,骨髓脂肪减少。 这些结论直接证明,大脑衰老不仅影响神经系统本身,还能通过主动的信号传递,加速远端器官的结构和功能衰退。 如果说谢辉团队的研究发现了大脑发出的“错误指令”,那么王斌团队的综述则系统性地描述了骨骼内部“执行系统”的崩溃过程。BMSCs作为骨骼系统的核心维护者,其衰老表现为多方面、多层次的功能衰退。 在形态上,BMSCs从年轻时的纺锤形、紧凑状态,逐渐变得扁平、体积增大,表面积可增加高达150%。同时,它们还会开始分泌一系列促炎因子、蛋白酶和生长因子(即衰老相关分泌表型),破坏骨骼微环境,抑制正常细胞功能,甚至影响造血系统的健康。 功能上的衰退则更为严重。王斌团队指出,衰老的骨髓间充质干细胞增殖能力显著下降,细胞周期几乎停滞,这意味着骨骼系统的自我更新与修复能力大幅减弱。最关键的分化能力也发生病理性偏移:成骨分化潜能下降,而成脂分化倾向增强,直接解释了为何衰老骨骼会出现“骨少脂多”的结构失衡。 至于BMSCs衰老的内在机制,王斌团队总结,端粒缩短、DNA损伤积累、氧化应激、表观遗传改变和自噬功能障碍等多种分子事件共同推动了骨髓间充质干细胞的衰老进程。其中,氧化应激在骨骼衰老中扮演着核心驱动者的角色。过量产生的活性氧不仅直接损伤DNA和蛋白质,还通过激活特定的信号通路如p53和p38 MAPK通路,强制细胞进入衰老状态。 从谢辉团队的研究看,WDFY1蛋白作为大脑发出的“衰老信号”,直接干扰了骨髓间充质干细胞的分化命运决策。而在王斌团队的综述中,已经处于衰老状态的骨髓干细胞,由于自身修复能力下降、应激抵抗减弱,更容易受到这种异常信号的负面影响。 这种“内外夹击”的模式解释了为何骨骼衰老往往呈现加速趋势。 令人担忧的是,这种病理通讯可能不仅限于大脑与骨骼之间。越来越多的研究表明,衰老可能本质上是一种系统性、传播性的过程,一个器官的衰老会通过类似的囊泡信号、炎症因子或代谢产物,“传染”给其他器官。 骨骼系统由于富含干细胞巢和活跃的组织更新,可能对这类系统性衰老信号更为敏感。这也解释了为何在多种年龄相关疾病中,如糖尿病、心血管疾病和神经退行性疾病,患者常常同时伴有骨骼健康问题。 基于如此复杂的骨骼衰老机制,再结合科学界近年来提出的多层次、多靶点的干预策略,未来的骨骼衰老干预治疗应该包含以下两个方面。 针对大脑来源的异常信号,谢辉团队的研究已经指出了明确的干预方向。理论上,可以开发能够穿过血脑屏障的小分子药物,抑制衰老神经元中WDFY1的表达,从源头减少“错误指令”的产生。 另一种策略是靶向细胞外囊泡的产生或递送过程。如果能够选择性地阻断携带WDFY1的囊泡从大脑释放,或阻止它们被骨髓干细胞摄取,就能切断这种病理性器官间通讯。 这一策略的优势在于,不仅改善骨骼健康,还会因为减少系统性衰老信号的传播,而对全身多器官功能产生积极影响。 在这一点上,王斌团队的综述中总结了多种有前景的策略。针对氧化应激这一核心驱动力,抗氧化剂如N-乙酰半胱氨酸已被证明可以减少骨髓干细胞内的活性氧积累,恢复其成骨分化能力。 针对细胞衰老的另一个关键特征——衰老相关分泌表型,mTOR抑制剂如雷帕霉素显示出抑制这种有害分泌的潜力。而针对表观遗传改变,DNA甲基转移酶抑制剂则可能逆转成骨基因的沉默状态。 从根本出发的修复策略在于细胞内在的年轻化。通过基因工程手段增强自噬相关基因如ATG7的表达,可以清除细胞内的损伤组分,恢复线粒体功能,从而延缓甚至逆转干细胞的衰老进程。 未来的抗骨骼衰老治疗,可能不再仅仅是补充钙片和维生素D。如果一剂药物能拦截从大脑发出的“衰老快递”,同时另一剂药物能重启骨髓干细胞内部的“年轻程序”,那么越来越多的老人重新挺直腰板走路的背影,将不是科学幻想。

来自大脑的“衰老快递”
骨骼内部的“衰老战场”
骨骼系统面临多重衰老压力
如何有效干预骨骼衰老?
上游干预策略

下游修复策略
参考资料:
[1] Chen CY, Wang Z, Hong CG, et al. Brain neuron-derived WDFY1 induces bone loss. Nature Aging. January 2026.
[2] Zhang W, Xie Y, Wang B. Senescence of bone marrow mesenchymal stromal cells: a narrative review of mechanisms, functional consequences, and rejuvenation strategies for age-related disorders. Stem Cell Research & Therapy. 2025;17(1):58.
