衰老是每个人都不想面对,但又无法避免的过程。而延缓衰老的进程一直是科学界努力的目标。近年来,全球科学家在延缓衰老药物研究领域投入巨大精力,其中以美国国家衰老研究所(NIA)的衰老干预测试计划(Intervention Testing Program, ITP) 结果最为卓越。
NIA早在2002年,就启动了ITP计划,在过去的二十年中,用30000多只遗传异质UM-HET3小鼠,系统评估了54种候选化合物,最终发现了13种能显著延长寿命的药物。最近一项发表在《The Journals of Gerontology》上的综述研究对ITP的结果综合对比发现:大多数干预手段对雄性小鼠的效果要优于雌性,甚至只对雄性小鼠有效果[1]。
延寿药物的“雄性偏好”现象
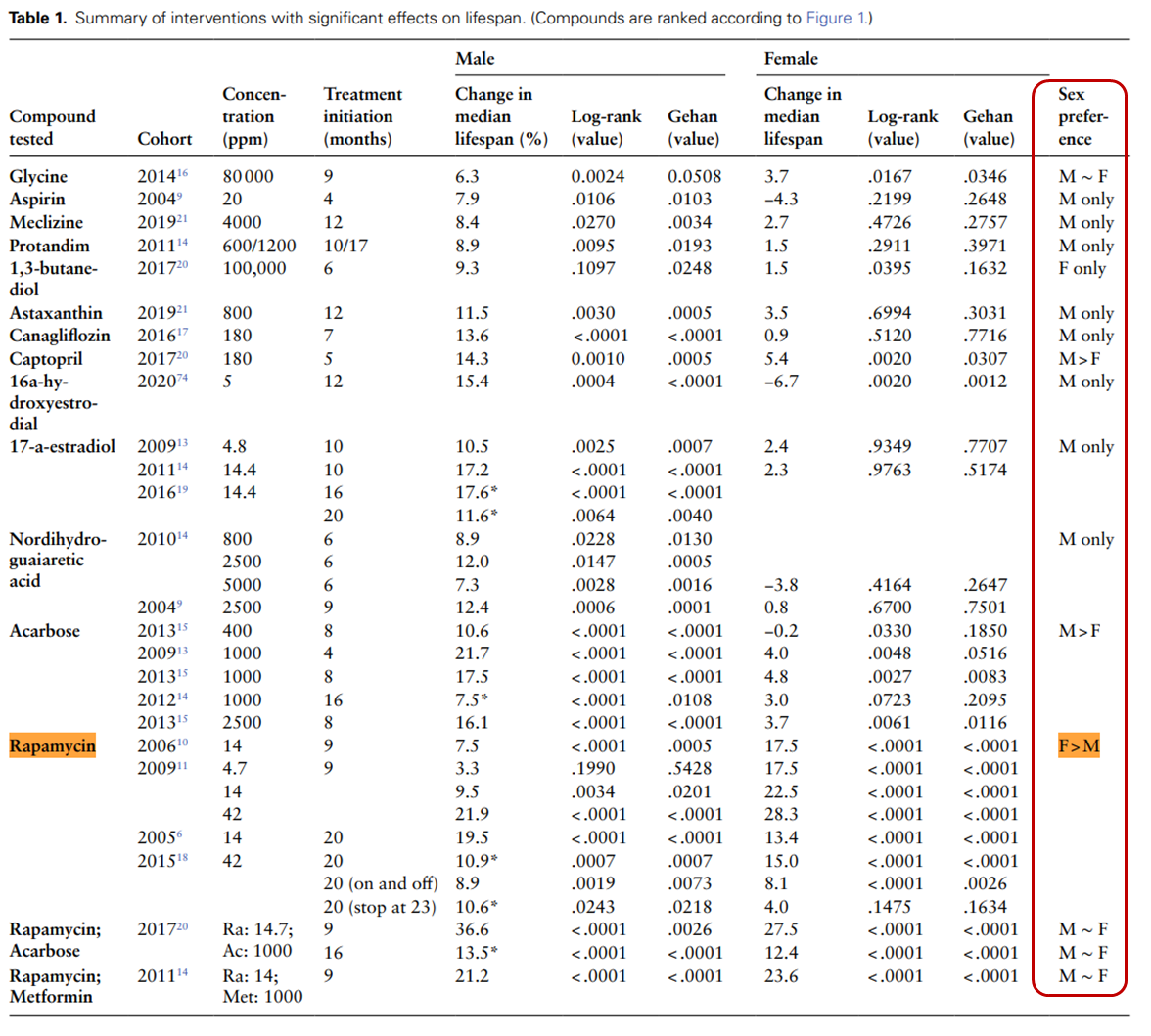
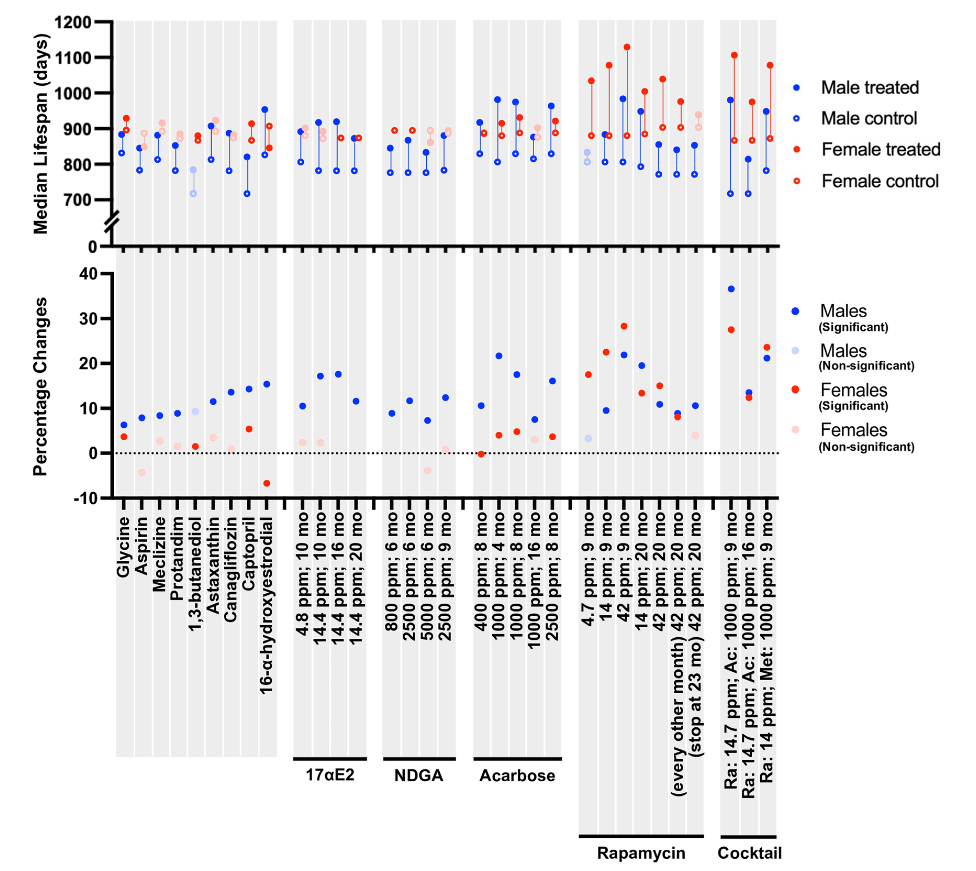
从下面表格中我们可以看出,在13种候选药物组成的15种干预方式中,只有雷帕霉素组显示出了雌性效果好于雄性,其余措施都是“雄性偏好干预措施”。甚至有些药物如阿司匹林、16α-羟基雌二醇、去甲二氢愈创木酸(NDGA)在雌性中甚至呈现负面趋势。
女性寿命更长,但男性更易“被延寿”
这是为什么呢?难道男性更长寿吗?
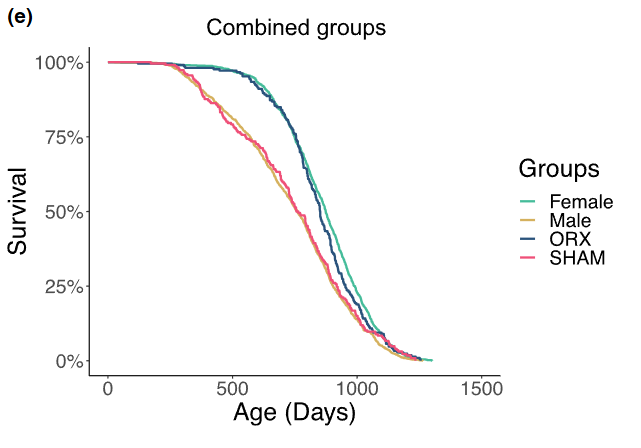
恰恰相反。无论是世界百岁老人数据,还是世界平均寿命统计,都明确显示女性平均寿命比男性长4-5岁。在动物界同样如此:未干预的UM-HET3雌鼠寿命比雄鼠长约16%。
这一看似矛盾的发现,揭示了男女衰老机制的不同,暗示着雄性生殖系统在加速衰老中扮演着重要的角色。
该研究团队在2023年的发表在《衰老细胞》上的研究还揭示:将雄性UM-HET3小鼠在青春期前进行阉割,可以降低雄性小鼠早年的死亡率,其寿命会延长至和雌性水平相当[2]。
造成“雄性更易衰老”的机制
造成“雄性更易衰老”的机制是非常复杂的,回到文章开头的表格,我们可以发现,展现出“雄性偏好性”的药物,适应症非常广泛。比如,用于治疗糖尿病的阿卡波糖和卡格列净;调节代谢的卡托普利;具有抗氧化作用的虾青素和普天登(Protandim);以抗炎为主的阿司匹林;以及调节激素水平的药物如NDGA、16α-羟基雌二醇和17α-雌二醇等。
由此,研究者推测,不同性别在代谢、炎症与氧化应激水平、以及激素水平方面的差异,可能是决定药物效果的关键因素,同时也可能是影响衰老进程的根本原因。
1、代谢差异:男性和女性在新陈代谢方面存在显着差异。男性更多地依赖葡萄糖来满足代谢需求,而女性则使用更多的脂质来获取能量。阿卡波糖、卡格列净(降糖药)等改善糖代谢的药物对雄性效果显著,因为它们恰好针对雄性的代谢短板。
2、炎症与氧化应激水平:雌激素具有一定的抗炎抗氧化能力,所以雄激素水平较高可能对应体内的氧化应激状态和炎症水平较高,因此雄性小鼠对抗炎、抗氧化剂如虾青素、普天登等的延寿敏感性也较高。
3、激素水平差异:睾酮在促进肌肉生长的同时,会升高氧化应激水平并抑制免疫效能。而雄性特异性延寿药物(如17α-雌二醇、NDGA)能抑制雄激素产生或睾丸功能,模拟阉割的延寿效应。
总之,这些结论都说明了一点,男性老得更快,更容易“被延寿”。
延寿药物“雄性偏好性”的应用启示
这项对ITP结果的分析,对未来的衰老干预研究,和候选化合物筛选及试验设计具有重要意义:
双性别检测的必要性
不同性别对同一药物的反应可能存在显著差异,因此在临床前动物实验中,应充分评估药物在雌性和雄性中的疗效,以确保药物对两性的适用性。有很多实验仅在雄性动物中测试药物,或混合测试,不区分双性别数据,结果很可能会误导临床应用。
个性化的治疗方案或成未来趋势
例如,对于男性,可能需要重点开发能够改善代谢途径和调节免疫系统的药物;而对于女性,则可能需要更多关注激素替代疗法和抗氧化剂等。
药物剂量和用药时间也需要根据性别进行调整。
雷帕霉素在雌性小鼠中需要高于42 ppm的剂量才能达到最大的延寿效果,而雄性小鼠需要14 ppm或更低的剂量效果最好。同理,阿卡波糖在雄性小鼠中,从8个月开始治疗的效果是从16个月开始的3倍。
药物联用策略需考虑性别
高浓度的雷帕霉素会在雄性小鼠中引发胰岛素抵抗,而联用阿卡波糖后寿命延长率从10% 提升至37%。但相同组合对雌性仅产生叠加效应,这说明相同干预手段对不同性别的延寿机制存在本质差异。
当延寿成为可能,男性或是更需干预的群体
衰老机制的性别二态性,似乎说明女性天然拥有生存优势,而男性在代谢、免疫上的特性使其更早地暴露于衰老的风险因素中。
而科学家在ITP中发现雄性小鼠对绝大多数延寿药物响应更强,这或许暗示着一个真相——在对抗衰老的战役中,男性或许是更需要外部干预的群体。
参考资料:
[1]Jiang, N. et al. Sex as a major determinant of pro-longevity drug efficacy: a review of two decades of the NIA Interventions Testing Program. PubMed 80, (2025).
[2]Jiang, N. et al. Prepubertal castration eliminates sex differences in lifespan and growth trajectories in genetically heterogeneous mice. Aging Cell 22, (2023).
Cover designed by Freepik.
