近年来,烟酰胺腺嘌呤二核苷酸(NAD⁺)在衰老干预领域的地位举足轻重,其在肾病中的研究也越来越丰富。一个非常关键的发现就是,NAD⁺可以预防急性肾损伤(AKI)、慢性肾病(CKD)等肾脏疾病的发生发展。具体怎么回事呢?还得从NAD⁺与肾脏之间的关系说起。
肾脏是仅次于肝脏的NAD⁺生物合成工厂
在此之前,我们需要了解一下什么是AKI和CKD?
AKI是因肾缺血(休克)、感染、肾毒性药物或尿路梗阻引发的肾功能急剧下降,有尿少、水肿、乏力及恶心等表现。CKD则是由糖尿病肾病、高血压、慢性肾炎或反复AKI导致的肾功能渐进性丧失,表现为长期高血压、贫血、泡沫尿及皮肤瘙痒。
AKI和CKD都会导致肾功能障碍,且这种障碍与肾小管代谢异常存在密切关系[1,2]。具体来说,作为肾脏工作量最大的功能单位,肾小管每天需要处理180升原尿的重吸收与分泌,因此具有很高的能量需求,其能量稳态的破坏会加剧肾脏疾病的进展,甚至导致肾衰竭。因此,作为参与数百种新陈代谢反应的小分子,NAD⁺在肾脏中的生物合成就显得尤为重要。
先前我们报道过,NAD⁺在体内的合成途径一共有三条:从头合成途径、Preiss-Handler途径和补救途径。具体文章在这里:《日本学者发现口服NMN/NR提升NAD+的全新机制》。
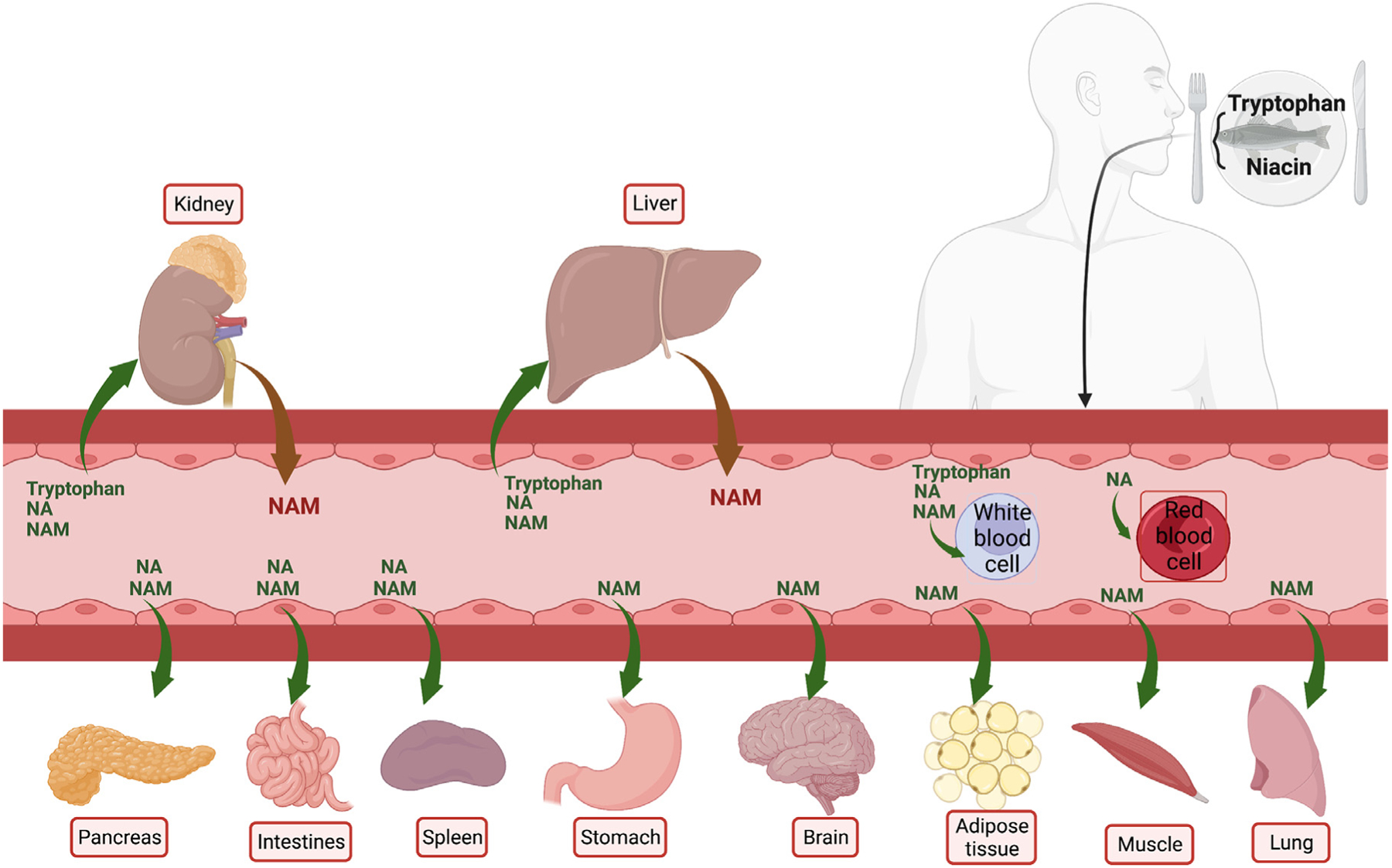
能同时利用这三条途径的器官主要是肝脏,然后就是肾脏,其他器官只能利用烟酸(NA)/烟酰胺(NAM)合成NAD⁺,而肾脏中合成的NAD⁺几乎都给自己用了,不像肝脏一样能为全身提供原料[2]。由此可见,NAD⁺稳态对维护肾脏代谢功能十分重要。
然而,在AKI和CKD小鼠的研究中均检测出NAD⁺水平降低[3-5],这是因为在AKI中,三条NAD⁺生物合成途径均受到抑制,其中从头合成途径的抑制效果最显著[2]。

比如,NAD⁺从头合成途径中有一个限速酶——喹啉酸磷酸核糖转移酶(QPRT),Mehr等人发现,若将QPRT表达下调,小鼠就会表现出更低的肾NAD⁺水平和更高的AKI易感性[6]。另外,NAD⁺水平持续降低,则会导致AKI进展为CKD[7]。
一句话总结就是,肾脏正常代谢需要大量的NAD⁺,一旦NAD⁺合成受阻,就会导致肾功能损伤,引起或加重AKI、CKD或肾早衰等疾病。
补充NAD⁺可从多条通路预防肾病
既然肾病是因为其本身的NAD⁺水平降低了,那我们给它补充一点不就行了?研究人员还真就这么做了,他们发现,补充NAD⁺前体,包括NAM和烟酰胺核苷(NR),可通过不同途径恢复肾损伤,防止肾病恶化。
口服NAM可弥补因QPRT导致的NAD⁺减少,预防AKI发生。
一项Ⅰ期临床研究结果显示,NAM可以通过中间体烟酰胺单核苷酸(NMN)促进NAD⁺的从头生物合成,且具有良好的耐受性[6]。
外源性NAM可增加前列腺素PGE2产生,恢复缺血性AKI导致的肾脏损伤。

PGC1α是一种线粒体生物发生调节因子,可通过调节NAD⁺生物合成恢复肾脏损伤。在缺血性AKI小鼠中,敲除PGC1α会导致肾NAM水平下降,肾损伤无法正常恢复。外源性NAM可提高NAD⁺水平并产生脂肪分解产物β-羟基丁酸酯,增加前列腺素PGE2的产生,而PGE2是一种维持肾功能的分泌性自体调节物质,可促进肾损伤恢复[8]。
补充NR可激活肾小管代谢,预防CKD。
肾近端小管中的脂肪酸氧化受损(FAO)是诱发CKD的原因之一。Jones等人发现,NR可以刺激肾脏PPARα信号传导并恢复近端小管中的FAO,从而预防CKD的发生[9]。不过,有研究显示,口服NR可能会直接被肝脏利用,转化为NAD⁺或NAM,进而被其他器官吸收利用,但小鼠静脉内给药可将完整的NR输送到肾脏[10]。
补充NR或NMN可减轻肾小管线粒体损伤,保护肾功能。
美国宾夕法尼亚大学医学系的研究人员发现,NAD⁺可抑制线粒体RNA(mtRNA)的细胞质释放和视黄酸诱导基因I(RIG-I)激活,而mtRNA/RIG-I会导致肾损伤期间的炎症反应。补充NR或NMN可恢复NAD⁺水平,并改善肾功能[11]。
补充NMN可通过上调的PPDPF提高NAD⁺水平,抵消肾功能损伤。
近期,《科学进展》杂志上的一项新研究在小鼠AKI模型和人类AKI患者的健康近端肾小管中发现,PPDPF(胰腺祖细胞分化和增殖因子)表达上调,并通过调节烟酰胺单核苷酸腺苷转移酶(NMNATs)的活性,促进NMN向NAD⁺转化[12]。也就是说,在PPDPF因子的表达上调时,补充NMN就可以促进NAD⁺的大量合成。研究人员表示,PPDPF因子是维持肾功能、抵消AKI和CKD引起的肾功能障碍的关键因素。
目前还不能直接补充NAD⁺,但或许很快就能实现
无论补充NR还是NMN都是为了提高肾内NAD⁺水平,那有人可能会问:“直接补充NAD⁺不行吗?”还真不太行,因为天然的NAD⁺分子自身存在诸多局限性,比如难以穿越细胞膜进入细胞内部、无法精准地作用于肾脏组织、在体内的稳定性不佳等,导致其生物利用度较差。
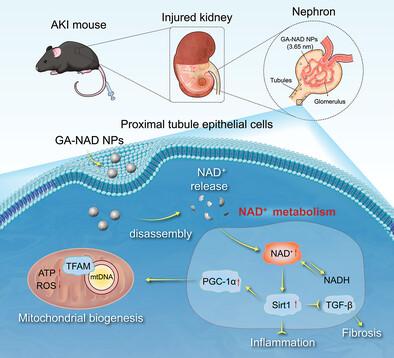
好在我国山东第一医科大学去年发表的研究提供了一个新策略,即利用天然多酚没食子酸 (GA)构建GA-NAD⁺纳米粒子,可有效靶向递送NAD⁺,在治疗 AKI 和 CKD方面可能会相对高效、安全[13]。
需要提醒的是,上述研究几乎都建立在小鼠实验的基础上,因此“补充NAD⁺或其前体可预防肾脏疾病及进程”在人类中是否依旧有效,或者是否有副作用,还需大量研究进行证明,我们可以拭目以待。
参考资料:
[1] Chanvillard L, Tammaro A, Sorrentino V. NAD+ metabolism and interventions in premature renal aging and chronic kidney disease. Cells. 2022;12(1):21.
[2] Clark AJ, Saade MC, Parikh SM. The significance of NAD+ biosynthesis alterations in acute kidney injury. Seminars in Nephrology. 2022;42(3):151287.
[3] Takahashi R, Kanda T, Komatsu M, et al. The significance of NAD + metabolites and nicotinamide N-methyltransferase in chronic kidney disease. Scientific Reports. 2022;12(1).
[4] Guan Y, Wang SR, Huang XZ, et al. Nicotinamide mononucleotide, an NAD+ precursor, rescues Age-Associated susceptibility to AKI in a sirtuin 1–Dependent manner. Journal of the American Society of Nephrology. 2017;28(8):2337-2352.
[5] Bugarski M, Ghazi S, Polesel M, Martins JR, Hall AM. Changes in NAD and lipid metabolism drive Acidosis-Induced acute kidney injury. Journal of the American Society of Nephrology. 2021;32(2):342-356.
[6] Mehr AP, Tran MT, Ralto KM, et al. De novo NAD+ biosynthetic impairment in acute kidney injury in humans. Nature Medicine. 2018;24(9):1351-1359.
[7] Bignon Y, Rinaldi A, Nadour Z, et al. Cell stress response impairs de novo NAD+ biosynthesis in the kidney. JCI Insight. 2021;7(1).
[8] Tran MT, Zsengeller ZK, Berg AH, et al. PGC1α drives NAD biosynthesis linking oxidative metabolism to renal protection. Nature. 2016;531(7595):528-532.
[9] Jones BA, Gisch DL, Myakala K, et al. NAD+ prevents chronic kidney disease by activating renal tubular metabolism. JCI Insight. 2025;10(5).
[10] Liu L, Su X, Quinn WJ, et al. Quantitative Analysis of NAD Synthesis-Breakdown fluxes. Cell Metabolism. 2018;27(5):1067-1080.e5.
[11] Doke T, Mukherjee S, Mukhi D, et al. NAD+ precursor supplementation prevents mtRNA/RIG-I-dependent inflammation during kidney injury. Nature Metabolism. March 2023.
[12] Fang X, Zhong Y, Zheng R, et al. PPDPF preserves integrity of proximal tubule by modulating NMNAT activity in chronic kidney diseases. Science Advances. 2025;11(12).
[13] Kong Y, Chen X, Liu F, et al. Ultrasmall Polyphenol‐NAD+ Nanoparticle‐Mediated renal delivery for mitochondrial repair and Anti‐Inflammatory treatment of AKI‐to‐CKD progression. Advanced Materials. 2024;36(30).
